第一三共/阿斯利康:德达博妥单抗
TROP2 ADC
2024 年 3 月,第一三共和阿斯利康联合开发的 TROP2 ADC 德达博妥单抗在国内报上市,用于治疗既往接受过系统治疗的 HR 阳性、HER2 阴性的不可切除或转移性乳腺癌成人患者,预计将于今年 Q3 获批。
关键性 III 期临床研究 TROPION-Breast 01 结果显示,在既往接受过内分泌治疗且至少一种全身系统性治疗、无法手术或转移性 HR+/HER2-乳腺癌患者中,德达博妥单抗治疗组的 mPFS 达 6.9 个月(vs 化疗组 4.9 个月),可将患者的疾病进展或死亡风险降低 37%。
德达博妥单抗是一款靶向 TROP2 的 DXd 抗体偶联药物 (ADC),最初由第一三共开发。2020 年 7 月,第一三共与阿斯利康达成一项超 60 亿美元的合作,在全球(日本除外)联合开发和商业化德达博妥单抗。该药已在欧美日获批治疗乳腺癌,并于日前获 FDA 批准治疗肺癌。

截图来源:Insight 数据库
亚盛医药:力胜克拉
亚盛医药力胜克拉(APG-2575 )在 24 年 11 月申报上市,并被纳入优先审评,用于治疗难治或复发性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者。Insight 数据库显示,力胜克拉是首个报上市的国产 BCL-2 抑制剂,预计今年 Q3 获批。
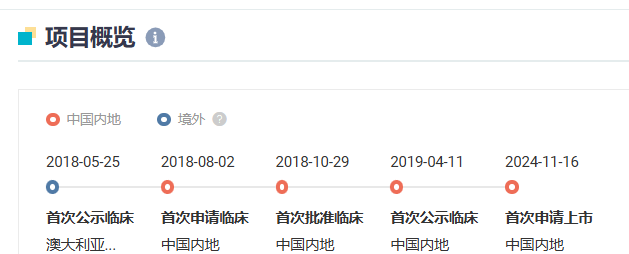
截图来源:Insight 数据库
23 年 ASH 年会上公布的力胜克拉对接受过大量治疗的 CLL 患者的疗效和安全性结果显示:
CLL 患者的 ORR 为 73.3%(33/45),CR/CRi 率为 24.4%(11/45),且 CR/CRi 率随剂量增加呈上升趋势。
外周血 MRD 检测患者中,38.9%(7/18)达到 MRD 阴性状态。通过骨髓 MRD 检测患者中,66.7%(4/6)为 MRD 阴性。
首次缓解中位时间为 2.07 个月,中位 PFS 为 18.53 个月,30 个月 OS 率为 86.3%,意味着力胜克拉具有为 CLL 患者带来长期生存获益的潜力。
此外,APG-2575 也在 R/R CLL 患者中表现出了良好的安全性和耐受性。
目前力胜克拉正在全球范围内同步推进两项治疗 CLL/SLL 的注册 III 期临床: 一项是 GLORA 研究,适应症为力胜克拉联合 BTK 抑制剂治疗 BTK 抑制剂经治 CLL/SLL 患者;另一项是 GLORA-2 研究,适应症为力胜克拉联合阿可替尼对比免疫化疗治疗治疗初治 CLL/SLL 患者。
在国内 BCL-2 赛道,目前仅有艾伯维的维奈克拉获批用于治疗 AML。国产药方面,除了亚盛的力胜克拉,百济神州的索托克拉也在今年递交了 CLL/SLL、MCL的上市申请。新一代 VEGF 单抗
2024 年 3 月 ,先声药业苏维西塔单抗国内报上市,适应症为联合化疗用于治疗含铂化疗治疗失败的复发性卵巢癌、输卵管癌或原发性腹膜癌,预计将于今年 Q3 获批。苏维西塔单抗是先声引进的一款新一代重组人源化抗 VEGF 兔源单克隆抗体。其治疗铂类化疗耐药卵巢癌的 Ⅲ 期 SCORES 研究(NCT04908787)已达到主要临床研究终点。2025 年 ASCO 大会上公布的数据显示:
必贝特医药:双利司他
全球首个报产的 PI3K×HDAC 双靶点抑制剂
2023 年 10 月,必贝特医药的双利司他国内报上市。该申请已被纳入优先审评,用于复发或难治性弥漫性大 B 细胞淋巴瘤(r/r DLBCL)成人患者的三线及以上治疗,预计将于 Q3 获批。
该药的上市申请是基于一项关键 IIb 期临床试验,研究共入组 93 例 r/r DLBCL 患者。数据显示,在主要研究终点——IRC 和研究者评估的 ORR 方面,双利司他均高于与 CDE 沟通的附条件上市要求,同时可显著延长患者的总生存期,并具有良好的安全性和耐受性。
此前,双利司他已在 IIa 期临床中取得积极效果:在 II 期推荐剂量(22.5 mg/m2)下,双利司他用于 r/r DLBCL 三线及以上治疗,ORR 为 50%,DCR 为 66.7%。
Insight 数据库显示,这是全球首个且目前唯一报上市的 PI3K×HDAC 双靶点抑制剂。对于 r/r DLBCL 三线及以上治疗,国内目前仅有德琪医药的 XPO1 抑制剂塞利尼索一款小分子化药获批,双利司他如若获批将给患者提供更多的治疗选择。
恒润达生:润达基奥仑赛
国内第 4 款 CD19 CAR-T
2023 年 12 月,恒润达生润达基奥仑赛国内报上市,用于治疗复发/难治性 B 细胞非霍奇金淋巴瘤(B-NHL),预测有望在今年 Q3 获批。这是国内第 4 款报上市的 CD19 CAR-T。
润达基奥仑赛(HR001)是一款靶向 CD19 的 CAR-T 产品。据恒润达生介绍,其自主开发的稳转细胞株病毒载体生产系统实现了病毒规模化生产,可有效降低包括润达基奥仑赛在内单剂 CAR-T 细胞治疗产品的成本。
润达基奥仑赛已完成治疗复发/难治 B-NHL 适应症的注册性 Ⅱ 期临床。Ⅱ 期临床数据显示(截至 2023 年 5 月 16 日):
3 个月时的 ORR 为 48%(49/103),ITT 集 ECOG 0-1 分的 90 例患者中有 46 例 3 个月时达到客观缓解,3 个月 ORR 为 51%,有效性优于挽救治疗。
安全性方面,103 例受试者中,有 46 例发生 SAE,CRS 发生率为 95.1%,其中 3 级以上 CRS 发生率为 5.8%;神经毒性事件发生率为 23.3%,3 级以上神经毒性事件发生率为 1%。

截图来源:Insight 数据库
诺华:镥 [177Lu] 特昔维匹肽
PSMA 靶向放射性配体疗法
2024 年 11 月,诺华重磅核药 Pluvicto 的(镥 [177Lu] 特昔维匹肽)上市申请获受理,并被纳入优先审评,适用于前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC) 三线治疗,预计将于 Q4 获批。今年 4 月,Pluvicto 已在国内申报了第 2 个适应症。
关键性 III 期临床试验 VISION 结果显示:Pluvicto+SoC 组的影像学无进展生存期(rPFS)为8.7 个月,而标准治疗(SoC)组只有 3.4 个月,总生存期(OS)为 15.3 个月,也高于标准治疗组的 11.3 个月。而且,与 SoC 相比,Pluvicto+SoC 可降低患者的死亡风险,以及患者出现放射学疾病进展或死亡的风险。
Pluvicto 是一款 PSMA 靶向放射性配体疗法,已在美国和欧盟获批上市。2024 年,Pluvicto 的销售额达 13.92 亿美元(YOY +42.04%),成为诺华又一个重磅炸弹药物。
截图来源:Insight 数据库
2024 年 12 月,GSK 的注射用玛贝兰妥单抗上市申请获得受理。该申请已被纳入优先审评,适应症为玛贝兰妥单抗与硼替佐米+地塞米松联合治疗既往接受过至少一种治疗的多发性骨髓瘤(MM)成年患者,预计将于 Q4 获批。
玛贝兰妥单抗是全球首款申报上市的 BCMA ADC。Ⅲ 期试验 DREAMM-7 评估了玛贝兰妥单抗+硼替佐米+地塞米松治疗复发/难治性 MM 患者的疗效和安全性,对照组为达雷妥尤单抗 +硼替佐米+地塞米松。研究主要终点是 PFS。
2025 年 ASCO 年会上公布的数据显示,在意向治疗人群 (ITT) 中:
中位 PFS 方面,玛贝兰妥单抗组还没有达到,达雷妥尤单抗组为 12.6 个月,玛贝兰妥单抗组将患者病情进展或死亡风险降低了61%(HR=0.39);玛贝兰妥单抗组的 18 个月 PFS 率为 69%,显著高于达雷妥尤单抗组的 41%。
玛贝兰妥单抗组 ORR 为 86%(vs 对照组 74%),CR 为 34%(vs 对照组 15%),18 个月 OS 率为 85%(vs 对照组 73%)。
勃林格殷格翰:宗格替尼
口服 HER2 抑制剂
2025 年 1 月,勃林格殷格翰的宗格替尼上市申请获得 CDE 受理。该药已被纳入优先审评,用于治疗携带 HER2(ERBB2)激活突变且既往接受过系统治疗的不可切除或转移性 NSCLC 成人患者,预计将于 Q4 获批。
宗格替尼 是勃林格殷格翰开发的一款不针对 EGFR 野生型的选择性 HER2 抑制剂。2024 年 4 月,中国生物制药已与勃林格殷格翰达成战略合作,双方将共同在中国内地研发和商业化勃林格殷格翰的肿瘤药物管线,其中就包括宗格替尼。
该药在国内的上市申请是基于一项 Ib 期临床研究 BEAMION LUNG-1 试验的结果。今年 AACR 上公布的更新数据显示,在携带 HER2 酪氨酸激酶结构域(TKD)突变的晚期 NSCLC 经治患者中(n=75),宗格替尼展现出持久且具有临床意义的疗效:
恒瑞医药:瑞拉芙普-α注射液
全球首个报产的 PD-L1/TGF-β 双靶点新药
2024 年 9 月 ,恒瑞 1 类新药瑞拉芙普-α注射液国内报上市,联合氟尿嘧啶类和铂类药物用于局部晚期不可切除、复发或转移性胃及胃食管结合部腺癌的一线治疗。Insight 数据库显示,这是全球首个报产的 PD-L1/TGF-β双靶点新药,预计今年 Q4 获批。
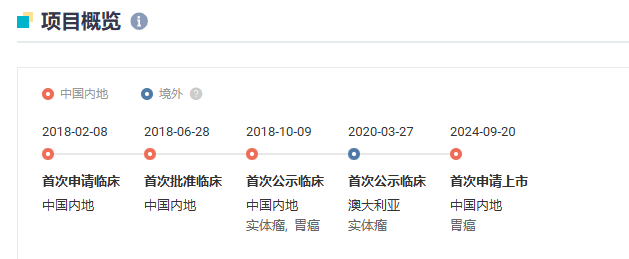
截图来源:Insight 数据库
瑞拉芙普-α(SHR-1701)是一款抗 PD-L1/TGF-βRII 双功能融合蛋白。24 年 ESMO 上公布的 Ⅲ 期试验 SHR-1701-Ⅲ-307数据显示,与安慰剂+化疗组相比,SHR-1701 +化疗组可显著延长胃癌或胃食管结合部腺癌患者的总生存期:
在 PD-L1 CPS≥5 人群中,SHR-1701 组中位 OS 为 16.8 个月,安慰剂组中位 OS 为 10.4 个月,HR=0.53,p<0.0001,达到统计学差异。
在 ITT 人群中,SHR-1701 组中位 OS 为 15.8 个月,安慰剂组中位 OS 为 11.2 个月,HR=0.66,p<0.0001,达到统计学差异。
在次要终点方面:
在 PD-L1 CPS≥5 人群中,SHR-1701 组和安慰剂组的 mPFS 分别为 7.6 个月、5.5 个月,HR=0.5;SHR-1701 组和安慰剂组确认的 ORR 分别为 56.5%、32.7%,DoR 分别为 10.2 个月、5.1 个月。
在 ITT 人群中,SHR-1701 组和安慰剂组 mPFS 分别为 7.0 个月和 5.5 个月,HR=0.57;SHR-1701 组和安慰剂组确认的 ORR 分别为 53.4% 和 32.8%,DoR 分别为 8.5 个月和 5.3 个月。
贝达药业:泰瑞西利
2024 年 5 月,贝达药业 1 类新药泰瑞西利在国内报上市,适应症为联合氟维司群用于既往接受内分泌治疗后进展的 HR+/HER2-的局部晚期或复发转移性乳腺癌,预计今年 Q4 获批。
泰瑞西利是一款具有全新结构的细胞周期蛋白依赖性激酶 CDK4/6 抑制剂。Ⅲ 期 BTP-66732 研究评估了泰瑞西利+氟维司群 vs 安慰剂+氟维司群治疗 HR+/HER2-的局晚期、复发或转移性乳腺癌的效果。
24 年圣安东尼奥乳腺癌研讨会(SABCS)上公布的更新数据显示,中位随访时间为 12.9 个月,泰瑞西利组的中位 PFS 为 16.5 个月(研究者评估),而安慰剂组仅为 5.6 个月;与安慰剂组相比,泰瑞西利组能够显著改善 PFS,将患者疾病进展或死亡的风险降低 63%(HR 0.37; P<0.0001),IRC 评估的 PFS 与研究者评估的结果一致。泰瑞西利安全性整体良好可控。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx