胆道癌双特异性抗体组合疗法ORR提高11.8%
4月2日,Compass Therapeutics公布Ⅱ/Ⅲ期临床试验COMPANION-002的积极结果。该研究评估了在研双特异性抗体tovecimig(原名CTX-009)联合紫杉醇在晚期胆道癌(BTC)患者中的疗效。主要终点为总缓解率(ORR)。数据显示,在二线治疗的BTC患者中,tovecimig联合紫杉醇组的ORR为17.1%(19/111,其中1例完全缓解),而紫杉醇单药组ORR为5.3%(3/57)。联合治疗组较单药组ORR提高11.8%,达到统计学显著性(p=0.031)。tovecimig可同时阻断Delta样配体4(DLL4)和血管内皮生长因子A(VEGF-A)信号通路,这两种通路对血管生成和肿瘤血管化至关重要。在经过大量既往治疗且对获批抗VEGF疗法耐药的癌症患者中,tovecimig单药治疗已观察到部分患者获得缓解。RNA疗法新锐1.55亿美元推进临床
4月1日,AIRNA公司宣布完成1.55亿美元B轮融资,将推动公司首款在研RNA编辑疗法AIR-001的Ⅰ/Ⅱ期试验,该疗法旨在治疗α1抗胰蛋白酶缺乏症(AATD)。同时也将有助于加强该公司含心血管代谢疾病在内的RNA编辑疗法管线。在AATD赛道,首家上市的碱基编辑公司Beam Therapeutics的一次性AATD基因疗法BEAM-302最近在Ⅰ/Ⅱ期试验中取得了早期成功,目前已在9名患者身上测试,数据显示该疗法可以降低突变蛋白水平并提高正常蛋白水平。在安全性方面,Beam公司表示未出现严重不良事件(SAE),仅观察到1级(轻度)肝酶升高,且这些患者无临床症状。国产口服KRAS G12D抑制剂首次获批临床
4月1日,CDE官网显示,海博为药业申报的1类新药HBW-012336 胶囊获批临床,用于携带KRAS G12D突变的局部晚期或转移性实体瘤。这也是该药在国内首次获批 IND。HBW-012336是一款口服KRAS G12D抑制剂。KRAS G12D突变是KRAS突变中最常见的类型,约占整个KRAS突变的35%,且更多的出现在胰腺癌、结直肠癌等难治及治疗预后差的癌症类型。首款国产实体瘤细胞疗法申报上市
近日,CDE官网显示,永泰生物申报的1类新药爱可仑赛注射液附条件新药上市申请获得受理。这是永泰生物在研的广谱性的细胞免疫治疗产品,为针对实体瘤的CIK(细胞因子诱导杀伤细胞)疗法。该产品已于今年3月正式被CDE纳入优先审评,拟定适应症为:原发性肝细胞癌根治术后高复发风险的部分人群【免疫特性人群:患者需满足以下标准中的至少两项:无微血管侵犯;术后中性粒细胞和淋巴细胞比值(NLR)<3;术后血小板和淋巴细胞比值(PLR)<110】术后预防复发治疗。 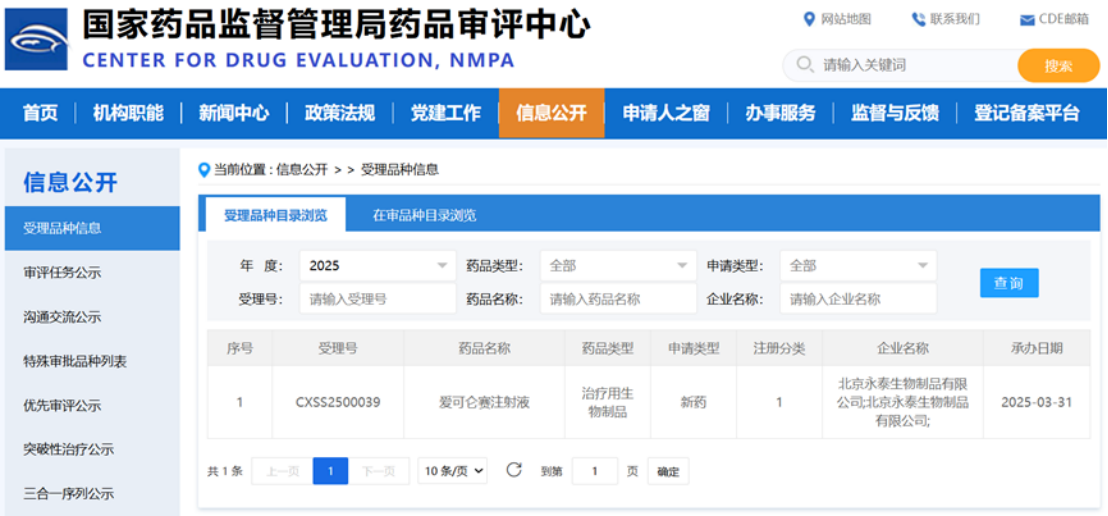
来源:CDE官网、各公司公告
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx