国内肿瘤领域的抗EGFR治疗将有望再添新的选择。
9月27日,乐普生物发布公告称,其候选药物维贝柯妥塔单抗(MRG003)的新药上市申请获得国家药监局受理并纳入优先审评。值得一提的是,该药是国内首个申报上市的靶向EGFR的抗体偶联药物(ADC)。根据CDE此前公示,MRG003此番申报的适应症为用于既往经至少二线系统化疗和PD-1/PD-L1抑制剂治疗失败的复发/转移性鼻咽癌(R/M NPC)患者。

在机制上,ADC可以看作化疗药物的靶向升级版。据悉,维贝柯妥塔单抗由EGFR靶向单抗与强效的微管抑制有效载荷甲基澳瑞他汀E(MMAE)分子通过缬氨酸-瓜氨酸链接体偶联而成,可以高亲和力特异性结合肿瘤细胞表面的EGFR,通过内吞及溶酶体蛋白酶裂解后释放强效的有效载荷,从而导致肿瘤细胞死亡。
当前,化疗药物仍在多数肿瘤的一线治疗中占据着重要地位。而作为能够实现精准制导的化疗药物,ADC拥有更为广阔的临床应用前景。在靶向EGFR的ADC开发赛道上,不乏艾伯维、阿斯利康、默克等跨国药企的身影;本土药企方面,除了乐普生物外,石药集团、百利天恒、信达生物等都在加速前进,一场市场争夺战即将打响。
同靶点产品全球畅销ADC药物补足短板作为一种跨膜蛋白,EGFR是表皮生长因子受体家族成员之一,在细胞生长、发育和分化过程中发挥重要作用。但EGFR的过度表达和异常激活可以调控多条信号转导通路,抑制肿瘤细胞凋亡,促进肿瘤细胞增殖、迁移,并通过介导VEGF表达促进肿瘤血管新生,进而在肿瘤的发生、发展、恶性侵袭等过程中发挥重要作用。
因此,通过药物阻断EGFR介导的信号传导通路,能够起到治疗肿瘤的效果。而按照结合EGFR所处位置的不同,目前已经获批上市的药物主要分为两大类,分别是作用于胞内域的小分子抑制剂和作用于胞外域的抗体类药物,其中的代表性药物都在市场上取得了优异的成绩。
例如阿斯利康开发的第三代EGFR-TKI奥希替尼是肺癌治疗领域的重磅药物,其在包括美国、欧盟、中国和日本在内的100多个国家或地区被批准单药治疗。作为一款明星抗癌药物,奥希替尼在2023年的全球销售额已经超过50亿美元,从2024年上半年32亿美元的销售成绩来看,其全年销售额有望突破60亿美元大关。
而由默克原研的西妥昔单抗注射液,在2004年作为全球首款抗EGFR单抗获批上市,现用于治疗头颈部癌和结直肠癌,其市场表现同样不俗。在2023年,西妥昔单抗注射液全球销售额约为17亿美元,是默克最畅销的抗癌药物。在中国市场,以超过65%降幅进入2018版国家医保药品目录的西妥昔单抗注射液市场增长迅速,其在2022年的销售额已经超过20亿元。
西妥昔单抗注射液销售情况(单位:万元)
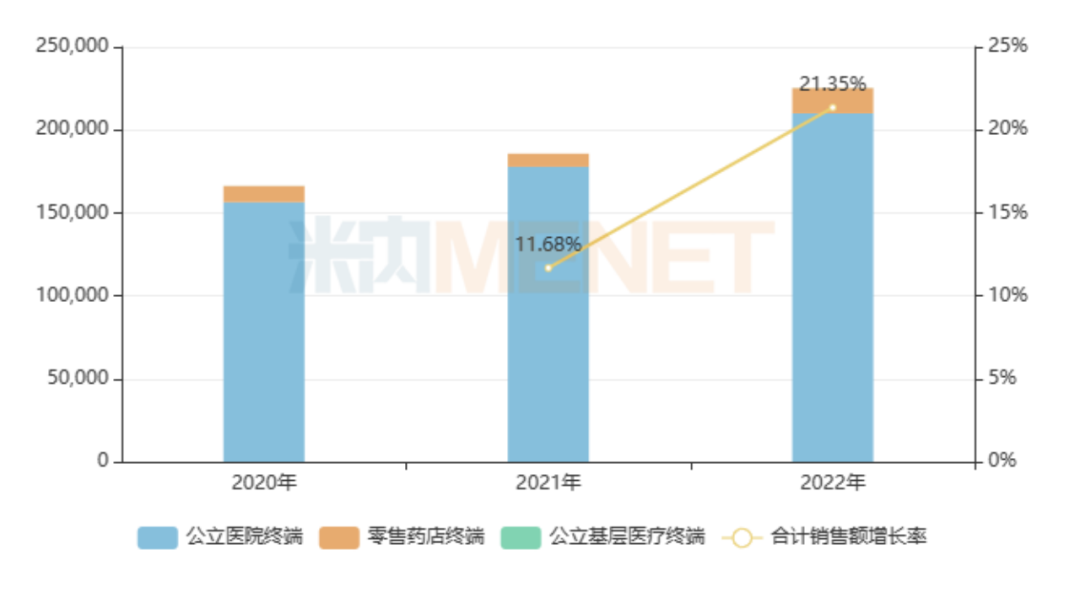
来源:米内网格局数据
但上述两类药物皆有其短板,业内观点认为,由于小分子抑制剂治疗常常会引发突变,导致患者产生治疗抵抗,因此需要药企不断开发新一代EGFR抑制剂以抵抗突变;此外,针对EGFR开发的抗体药物,往往也需要与化疗联用以增强疗效。在此背景下,EGFR靶向ADC的开发走到了台前。
拆分自乐普医疗的乐普生物是ADC赛道的重要玩家,承载着母公司发力肿瘤创新药的期盼,但旗下目前已实现商业化的品种仅有PD-1抑制剂普特利单抗。随着此番MRG003报产,乐普生物有望迎来新的业绩增长引擎。事实上,MRG003最初由上海美雅珂研发。2018年7月,乐普生物通过收购上海美雅珂的控股权益,从而拥有了ADC开发平台,并获得了包括MRG003在内的ADC候选药物的全球权利。
乐普生物ADC管线及候选药物开发情况

针对此次申报的NPC适应症,乐普生物曾在2023年ESMO年会上公布过MRG003在相关患者中的初步剂量探索IIa期研究(NCT05126719)结果。有效性数据显示,接受2.0 mg/kg剂量治疗的DL1队列中有28名患者可评估,ORR为39.3%,DCR为71.4%;接受2.3 mg/kg剂量治疗的DL2队列中有29名患者可评估,ORR为55.2%,DCR为86.2%。根据乐普生物2024年中报,MRG003当前已经完成NPC IIb期关键临床研究的患者入组。
鉴于EGFR还在头颈部鳞状细胞癌(SCCHN)和结直肠癌(CRC)等多种实体瘤中过表达,乐普生物也正在进行MRG003治疗SCCHN的随机开放多中心III期临床研究。同时,基于自家的PD-1抑制剂已经获批上市的优势,乐普生物亦正在通过与癌症免疫的联合疗法进一步探索MRG003的潜力。
其中,MRG003与普特利单抗联合治疗实体瘤的I/II期临床研究初步数据还入选了2024年ASCO大会的口头报告环节。截至2024年1月30日,该研究入组了33例患者(I期9例NPC、1例SCCHN和3名其他实体瘤患者,II期14例NPC和6例SCCHN患者)。I期研究中的ORR及DCR分别为53.8%及84.7%;在II期至少接受一次肿瘤评估的NPC及SCCHN患者中,ORR分别为77.8%及60%,DCR分别为100%及80%。
有数据显示,89%的晚期NPC存在EGFR表达,这也让EGFR成为该瘤种治疗的重要靶点。基于在R/M NPC人群中显著的疗效数据,美国FDA曾授予MRG003孤儿药资格、快速通道资格和突破性疗法,CDE此前也授予MRG003突破性治疗药物认定,加上此番被纳入优先审评,该药有望加速在海内外实现获批。这意味着,西妥昔单抗这一明星在遭遇生物类似药围堵的同时,也将迎来新的市场劲敌。
在研药物超70款本土药企跑入全球赛场根据沙利文的统计及预测,在2018年,国内抗EGFR单抗的结直肠癌及鼻咽癌市场销售额为12.8亿元;至2023年和2030年,结直肠癌及鼻咽癌市场销售额将分别增加至38.5亿元和66.2亿元。而如果EGFR抗体在未来能获批其他瘤种的适应症,其市场规模有望进一步扩大。但毫无疑问,凭借精准制导的优势,EGFR靶向ADC将成为其中最具竞争力的搅局者。
作为重要的肿瘤治疗靶点,药企针对EGFR的研发始终在路上,其中ADC/双抗ADC正在成为新一代EGFR靶向药物研发的重要方向。目前,全球仅有Rakuten Medical开发的EGFR靶向ADC药物Akalux(cetuximab saratolacan)在日本上市。但该药物并不是传统意义上的ADC药物,而是一种光敏ADC,治疗时需要利用光敏剂被690nm的红光照射激活,从而在靶细胞中产生活性氧(ROS)的特性,可用于消耗肿瘤浸润性调节性T细胞,杀死肿瘤细胞,同时刺激抗癌免疫反应。
事实上,EGFR靶向ADC的临床开发由来已久。智慧芽新药情报库数据显示,全球在研的EGFR靶向ADC超过了70款,其中十余款正处于临床试验阶段。但这条路并不好走,艾伯维是其中的首批耕耘者,其先后开发了ABT-414、ABBV-221等多款EGFR靶向ADC药物,都部分遭遇了失败。
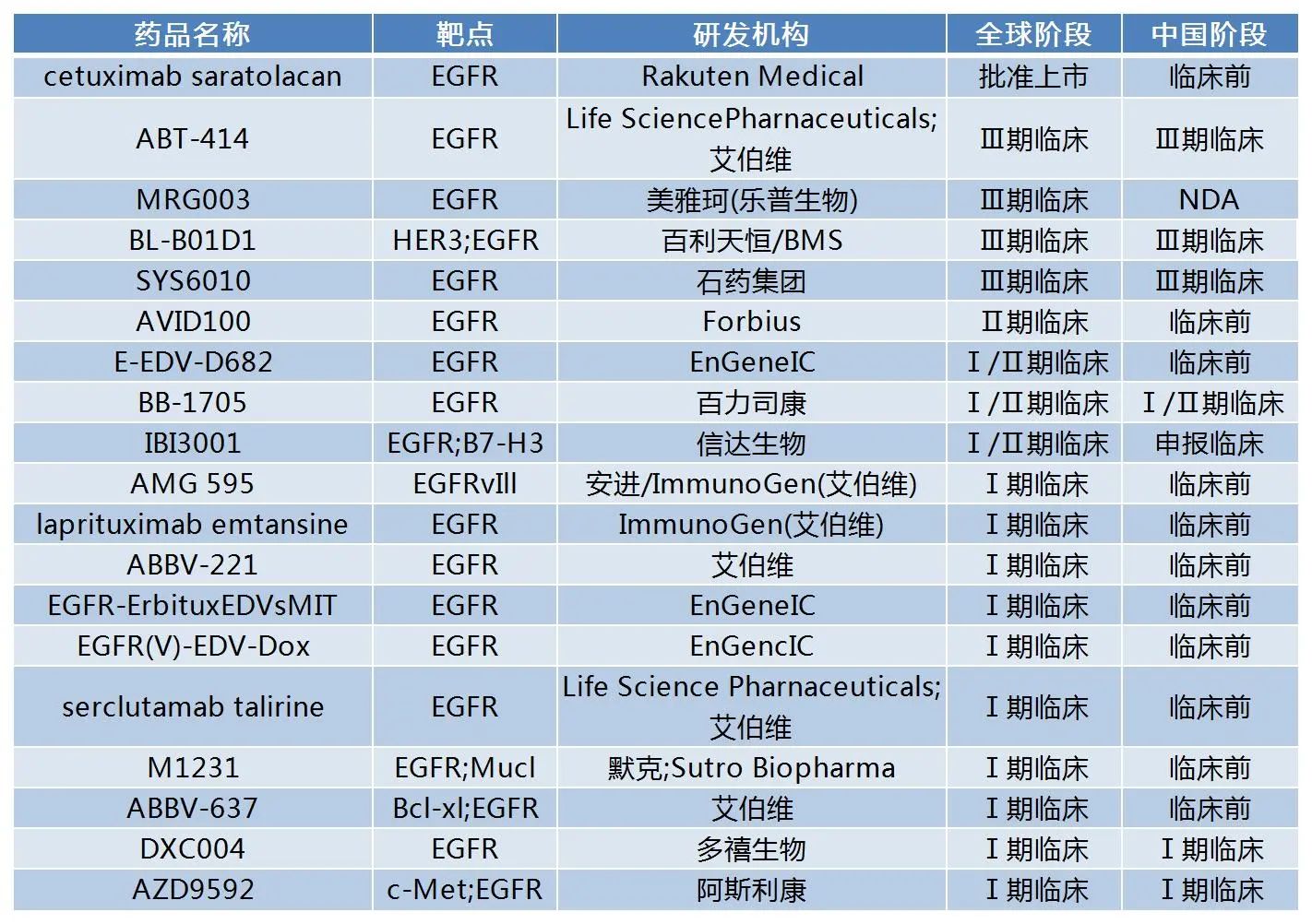
其中,ABT-414采用Seagen的ADC技术,由EGFR人源化抗体ABT-806、不可切割的马来酰亚胺卡洛(mc)Linker和MMAF组成。2019年5月,艾伯维公布了ABT-414一线治疗EGFR阳性GBM的III期INTELLANCE-1研究的中期分析结果:相比于安慰剂+标准治疗(放疗+替莫唑胺),接受ABT-414+标准治疗的患者并未获得生存期获益。因此,独立数据监测委员会建议该研究提前终止,艾伯维也随即终止了该药的临床开发计划。
艾伯维独立研发的ABBV-221是新一代的EGFR ADC,相较于前代产品ABT-414,其在抗体、毒素和连接子三个关键组成部分进行了改进。抗体部分AM1能够非特异性地靶向EGFRvIII,并且能够与野生型EGFR结合,从而增强了对EGFR靶点的结合力;毒素部分替换成MMAE以减少眼部毒性的风险;抗体药物比值被调整至3,以期达到更佳疗效和安全性平衡。但在针对实体瘤的I期临床研究中,ABBV-221并未展现出预期效果,也被艾伯维叫停。
但先行者探索走过的路,为后来者照亮了远途,研发进度靠前的本土药企正在加速跑入全球赛场。在EGFR ADC/双抗ADC领域,除了已经报产MRG003的乐普生物外,石药集团的SYS6010、百利天恒的伦康依隆妥单抗(BL-B01D1)皆已处在临床III期阶段。
与乐普生物的MRG003相同,石药集团开发的SYS6010也是EGFR ADC,其抗体部分是靶向EGFR的重组人源化抗体SYS6010 mAb,可特异性结合到表达EGFR的细胞表面并内化入细胞,Linker-Drug为四肽连接子GGFG偶联拓扑异构酶Ⅰ抑制剂JS-1。但不同的是,SYS6010的联用方案搭档并非PD-1抑制剂,而是阿斯利康的当家产品奥希替尼。
今年8月,药物临床试验登记与信息公示平台显示,SYS6010启动了Ib/III期临床试验,拟评估该药物联合奥希替尼治疗EGFR突变型局部晚期或转移性非小细胞肺癌(NSCLC)患者的安全性和有效性。
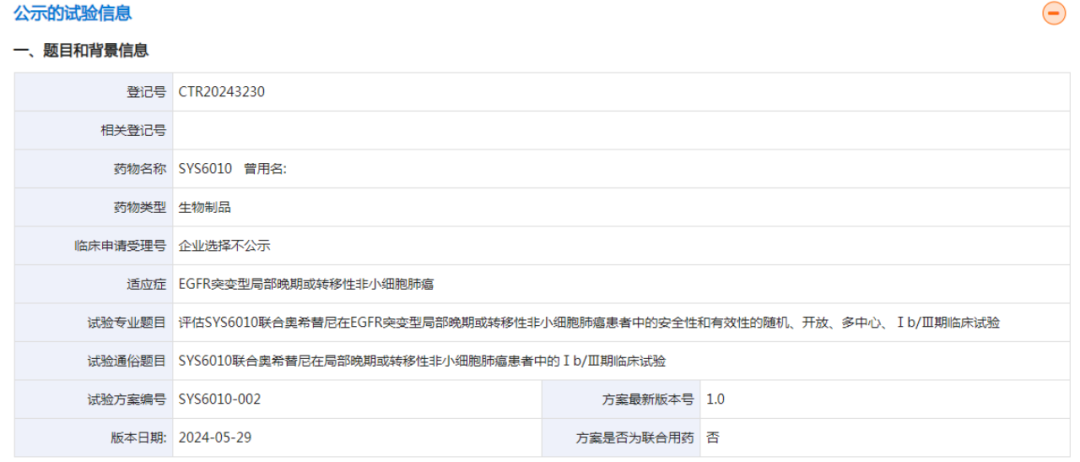
其中,Ib期研究部分拟在既往标准治疗失败的EGFR突变型局部晚期或转移性NSCLC患者中评估SYS6010联合奥希替尼的有效性、安全性、耐受性和III期推荐剂量(RP3D);剂量选择期和III期研究部分拟在既往未接受过EGFR-TKI或其他系统性治疗的EGFR突变型局部晚期或转移性NSCLC患者中评估SYS6010联合奥希替尼的有效性和安全性,既往接受过辅助/新辅助化疗但治疗结束6个月后疾病进展的NSCLC患者也可被纳入该部分参与试验。
百利天恒开发的BL-B01D1是一款基于双特异性抗体和拓扑异构酶抑制剂的ADC药物,该药物可同时结合肿瘤细胞上的EGFR和HER3,由此获得靶向性和抗肿瘤活性两方面的增强。2023年12月,BMS以8亿美元首付款、潜在总价值最高达84亿美元的“天价”,将BL-B01D1的海外权益收入囊中。该交易不仅刷新了全球ADC类药物单品交易总价的纪录,也创下国内创新药License-out交易的首付款及总交易额双项纪录。
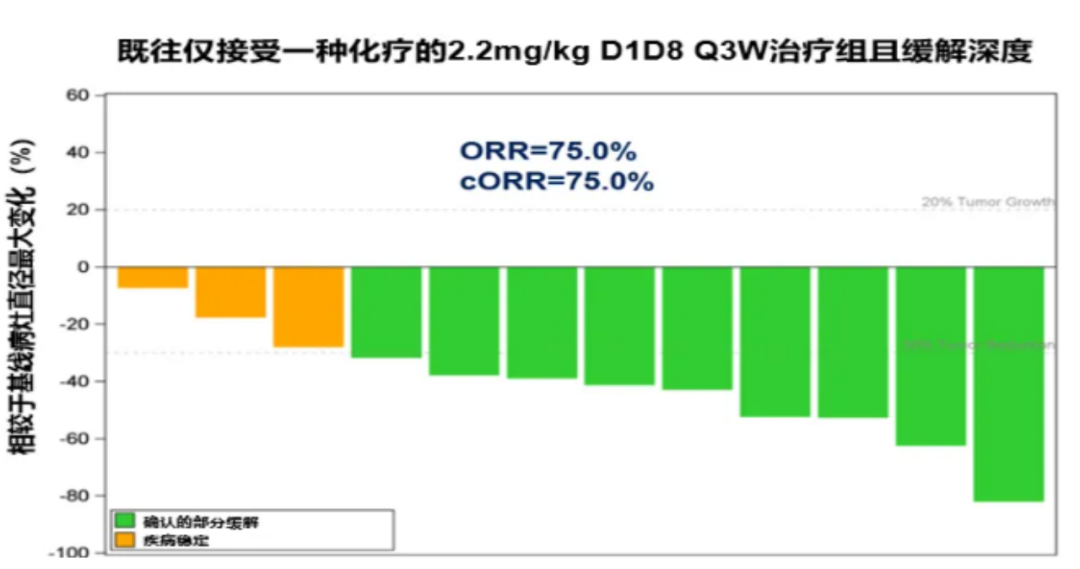
作为我国首款成功出海的双抗ADC药物,BL-B01D1的临床潜力正在展现。在刚刚闭幕的2024年ESMO年会上,百利天恒首次公布BL-B01D1在尿路上皮癌(UC)、食管鳞癌(ESCC)和胆道癌(BTC)的安全性和有效性数据。其中,BL-B01D1用于局部晚期或转移性UC的研究结果入选大会口头报告,在既往接受过一线化疗的患者中,ORR达到90%。此外,ESCC后线治疗的ORR达42.3%,mPFS达5.0个月;BTC后线治疗的ORR达28.6%,DCR达76.2%。
百利天恒预计,BL-B01D1将于2026年或之前向NMPA提交首个适应症的NDA申请,最早于2028年向美国FDA提出首个BLA申请。
在业内看来,ADC赛道近年来异军突起,截至目前,已有10余款单抗ADC药物分别在肺癌、乳腺癌等多个瘤肿中获批适应症。而有EGFR-TKI奥希替尼和抗EGFR单抗西妥昔单抗两款重磅炸弹药物的傲人成绩单在前,业界对更具优势的EGFR靶向ADC充满了期待,其将如何改写临床实践并催生出更大的抗EGFR治疗药物市场规模,答案呼之欲出。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx