中国创新药正成为跨国药企扩充研发管线的重要来源,承载着后者开启新一轮业绩增长的期望。
日前,默沙东对外宣布,其与同润生物达成最终协议,将通过子公司支付7亿美元的现金首付款,获得后者新型在研临床阶段CD3/CD19双特异性抗体CN201的全部全球权利。此外,基于CN201的开发和获批相关进展,同润生物也将获得最高6亿美元的里程碑付款。13亿美元的交易总额,使得沉寂已久的CD3/CD19双抗再度回到产业的聚光灯下。

据悉,CN201目前处于1期和1b/2期临床试验阶段,分别用于治疗复发或难治性非霍奇金淋巴瘤(R/R NHL)和复发或难治性B细胞急性淋巴细胞白血病(R/R B-ALL)。初步临床数据显示,CN201在这类恶性肿瘤患者中具有良好的治疗前景。而除了计划评估CN201作为B细胞恶性肿瘤疗法的表现外,默沙东还将研究该药作为自免疾病新型可扩展疗法的潜力。
重金押宝中国创新药背后,凸显的是默沙东想要增强并丰富在研管线的迫切性。当前,默沙东正处于多事之秋:撑起营收半壁江山的顶梁柱产品K药逼近专利悬崖,第二重要产品HPV九价疫苗Gardasil全球销售状况骤变。加快布局多元管线,寻找新产品支撑“后K药时代”业绩,是默沙东的头等大事,CN201能否承载得住这份重量?将迎接多少市场挑战?
全球全部权利被“买断”
CN201能成自免赛道大药?据东方证券统计,目前全球共有14款获批上市且仍在销售的双抗药物,主要类型为T细胞接合器(TCE)。公开资料显示,TCE双抗指的是一种能同时结合肿瘤相关抗原(TAA)和T细胞上CD3的双特异性抗体。开发者如此设计目的,是希望TCE双抗将T细胞定向到肿瘤细胞,从而使T细胞能有效地杀伤肿瘤细胞。
这次交易的主角CN201,便是一款由同润生物开发的新型靶向CD3/CD19的TCE双抗。据悉,CD19在B细胞恶性肿瘤中广泛且高度表达,并且其表达在疾病的不同阶段持续稳定。这些特征,使得CD19成为这类血液肿瘤强有力的治疗靶标。目前,全球已获批上市的6款靶向CD19的CAR-T细胞产品,均在血液肿瘤患者中表现出持久的完全反应。
同样,CN201也在B细胞恶性肿瘤中展现出不俗的治疗潜力。在2024年ASCO期间,研究者口头报告了CN201在治疗R/R B-ALL患者的Ⅰ期临床试验(NCT05579132)进展,这项研究旨在探索CN201治疗B-ALL的安全性、耐受性和初步疗效,确定最大耐受剂量(MTD)和推荐II期剂量(RP2D)的安全性和耐受性。
截至2024年4月22日,本研究中共有51例成人患者接受了目标剂量(从0.60mg到60mg)的CN201治疗,且尚未达到最大耐受剂量。在目标剂量达到10mg及以上的24例入组患者中有16例获得了完全缓解(CR/CRi),总反应率达到67%,微小残留病(MRD)阴性率93.7%;在目标剂量达到20mg及以上的16例入组患者中有12例获得了CR/CRi,总反应率达到75%,MRD阴性率91.7%。
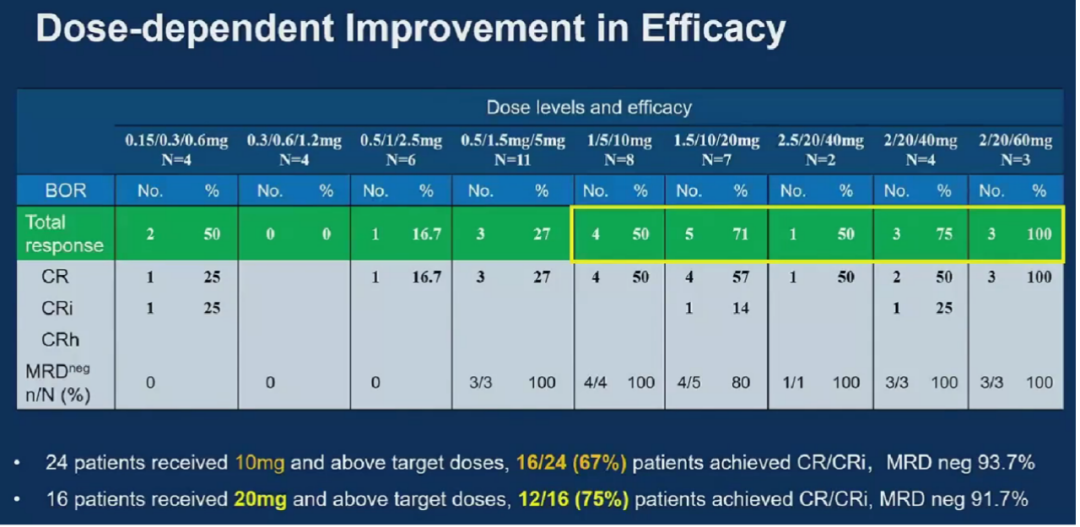
在安全性方面,该研究中有15例(29.4%)患者出现细胞因子释放综合征(CRS),主要发生在首次给药后,除2例为3级外,大多数为低级别。未观察到免疫效应细胞相关神经毒性综合征(ICANS),总体安全性良好。在业内看来,CN201能够拥有如此突出的疗效和安全性,是源于其独特的结构设计。
成立于2018年7月的同润生物实际上是由药明生物孵化而来,其在成立一个月后就完成1.5亿美元A轮融资,由通和毓承、博裕资本以及淡马锡共同投资。其中,通和毓承便是由在2015年独立出来的药明康德投资部门(更名为毓承资本)联合通和资本组建的私募基金。根据同润生物的专利披露(CN109535257B),CN201的构建采用了药明生物的Wuxibody双抗平台。
事实上,该双抗平台早已名声在外。2023年1月,GSK重金从药明生物引进了4款TCE双抗/多抗产品,交易总金额为15亿美元。截至2023年底,WuXiBody双抗平台共达成45个对外授权项目,其中4个处于I期临床开发阶段,包括在2021年5月通过专利变更转移到同润生物的CN201。
据研究者介绍,作为一款新型的CD3/CD19的TCE双抗,CN201在结构上进行了一定的优化,增加了采用IgG4亚型的Fc段,并且改良了CD3端的结构以调节其亲和力,减低CRS的发生率。结构上的优化也提高了CN201的依从性,其输注方法为每周一次,每次持续2-3 h左右,在治疗便捷性方面得到了明显的提升。
血液肿瘤的治疗前景和良好的依从性与安全性,或许都不是默沙东出手的最主要原因,该药在自免疾病领域的应用潜力才是关键。在业内看来,相较于传统单克隆抗体,TCE双抗则是直接激活并引导T细胞对目标细胞进行杀伤,该机制类似于目前备受瞩目的CAR-T细胞疗法。因此,TCE双抗在适应症拓展上也与CAR-T细胞疗法相似,自免疾病正成为其在肿瘤以外的下个趋势。
在某些自免疾病中,B细胞可能会错误地攻击身体自身的组织,导致疾病发生。CN201作为B细胞耗竭疗法,通过减少这些有害的B细胞,有望帮助控制或治疗这些疾病。这一治疗概念已于2024年4月被验证,研究者在Nature Medicine发文,证实了TCE双抗是一种可行的类风湿性关节炎等B细胞介导的自免疾病的治疗方法。

这也是默沙东时隔4个月后,愿意拿出7亿美元首付款“买断”CN201全球全部权利的最大诱因。在自免疾病领域,默沙东目前已上市的产品包括全人源化抗肿瘤坏死因子α(TNF-α)单克隆抗体戈利木单抗(Simponi)和特异性阻断TNF-α的人鼠嵌合型单克隆抗体英夫利昔单抗(Remicade)等。但由于已过专利期,受生物类似药冲击,这些产品的销售额都出现了下滑趋势。
因此,面对激烈的市场竞争,默沙东亟须通过收购和研发新产品来增强其在自免领域的市场地位。2023年6月,默沙东斥资108亿美元收购Prometheus Biosciences获得Tulisokibart (MK-7240)。该产品具有抗炎症和抗纤维化双重作用机制,是潜在FIC和BIC的TL1A靶向药物。此番再次大手笔拿下同润生物的CN201,默沙东在自免疾病领域的市场野心已不是秘密,但CN201能否担起这份重任,还有待未来临床开发的进一步检验。
安进、阿斯利康领跑
CD3/CD19双抗还有何机会?当前,双抗药物已经进入全球收获期,其中多数在近三年内获批上市。在2023年,已有2款双抗产品全球销售额超过10亿美元,且都来源罗氏。其中,FIX / FX双抗药物艾美赛珠单抗销售额高达46.2亿美元,同比增长16%;此外,Ang2/VEGF双抗药物法瑞西单抗销售额也达到26.3亿美元,同比增长率高达324%。不难发现,全球双抗药物的销售额正在高速增长。
而聚焦潜力巨大的CD3/CD19双抗,入局者不只有默沙东。早在2014年,安进基于BiTE分子技术平台开发的CD19/CD3双抗药物贝林妥欧单抗(Blinatumomab)便获美国FDA批准上市,开启了急性淋巴细胞白血病(ALL)患者的免疫治疗新时代。2020年12月,安进也携手百济神州,将这款重磅药物成功引进中国市场。
根据安进财报,在2023年,贝林妥欧单抗全球销售额达到8.61亿美元,同比增长了48%,距离“重磅炸弹”药物仅有一步之遥。在2024年上半年,贝林妥欧单抗全球销售额继续攀升,达到5.08亿美元,同比增长27%。安进在财报中明确,拓宽贝林妥欧单抗一线治疗B细胞恶性肿瘤的适应症和加快开发皮下给药剂型,将是接下来的工作重点。

值得注意的是,安进也在电话会中强调了贝林妥欧单抗在自免疾病领域的临床进度领先。事实上,在上述验证CD3/CD19双抗在自免领域有效性的研究中,研究者使用的便是安进的贝林妥欧单抗。
在这项研究中,研究团队基于同情用药原则,使用非常低剂量贝林妥欧单抗治疗了6名严重多药耐药的类风湿性关节炎患者。结果显示,低剂量的贝林妥欧单抗治疗成功导致了B细胞耗竭并伴随T细胞数量减少,证明了其接合T细胞和B细胞的功能。超声和FAPI-PET-CT成像诊断显示,患者的滑膜病变得到改善,并降低了自身抗体水平。
除了类风湿性关节炎外,2024年6月,安进的贝林妥欧单抗首次在系统性硬化(SSc)的ITT数据也在European Journal Of Cancer上发表。结果表明,贝林妥欧单抗可以实现深度B细胞耗竭,带来皮肤评分(mRSS)的改善和肢端灌注的改善,且安全性良好。
看中CD3/CD19双抗临床应用潜力的还有阿斯利康。2022年7月,阿斯利康宣布将以12.65亿美元的价格收购TeneoTwo公司,这份协议包括处于I期临床阶段的药物TNB-486(AZD0486)。根据协议条款,阿斯利康将收购TeneoTwo的所有未偿股权,以换取交易完成时的1亿美元预付款。此外,阿斯利康将向TeneoTwo的股东支付高达8.05亿美元的额外或有研发相关里程碑付款以及高达3.6亿美元的额外或有商业相关里程碑付款。
两次规模相当的交易,足以显示制药巨头对CD3/CD19双抗的器重,AZD0486也没让阿斯利康失望。在2023年ASH上,阿斯利康公布了AZD0486正在进行的I期FIH研究中实施双次剂量递增给药后更新的安全性数据。结果显示,中位随访5.72个月,整体患者ORR为86%。
就在默沙东公布官宣这笔交易的同一天,阿斯利康也在clinical trials网站上登记一项III期临床试验(NCT06549595),加快推进AZD0486的临床开发。据悉,该临床研究旨在评估AZD0486联合CD20抗体rituximab在一线滤泡性淋巴瘤患者中的疗效,预计将于2024年8月启动,计划入组人数为1005例。
据东北证券统计,当前全球处于临床开发阶段或已获批的双抗产品近400款,绝大多数管线仍处于早期临床阶段。其中近一半的双抗/多抗项目由国内公司开发,国产药物已在该领域占据重要地位,CD3/CD19双抗赛道也不例外。
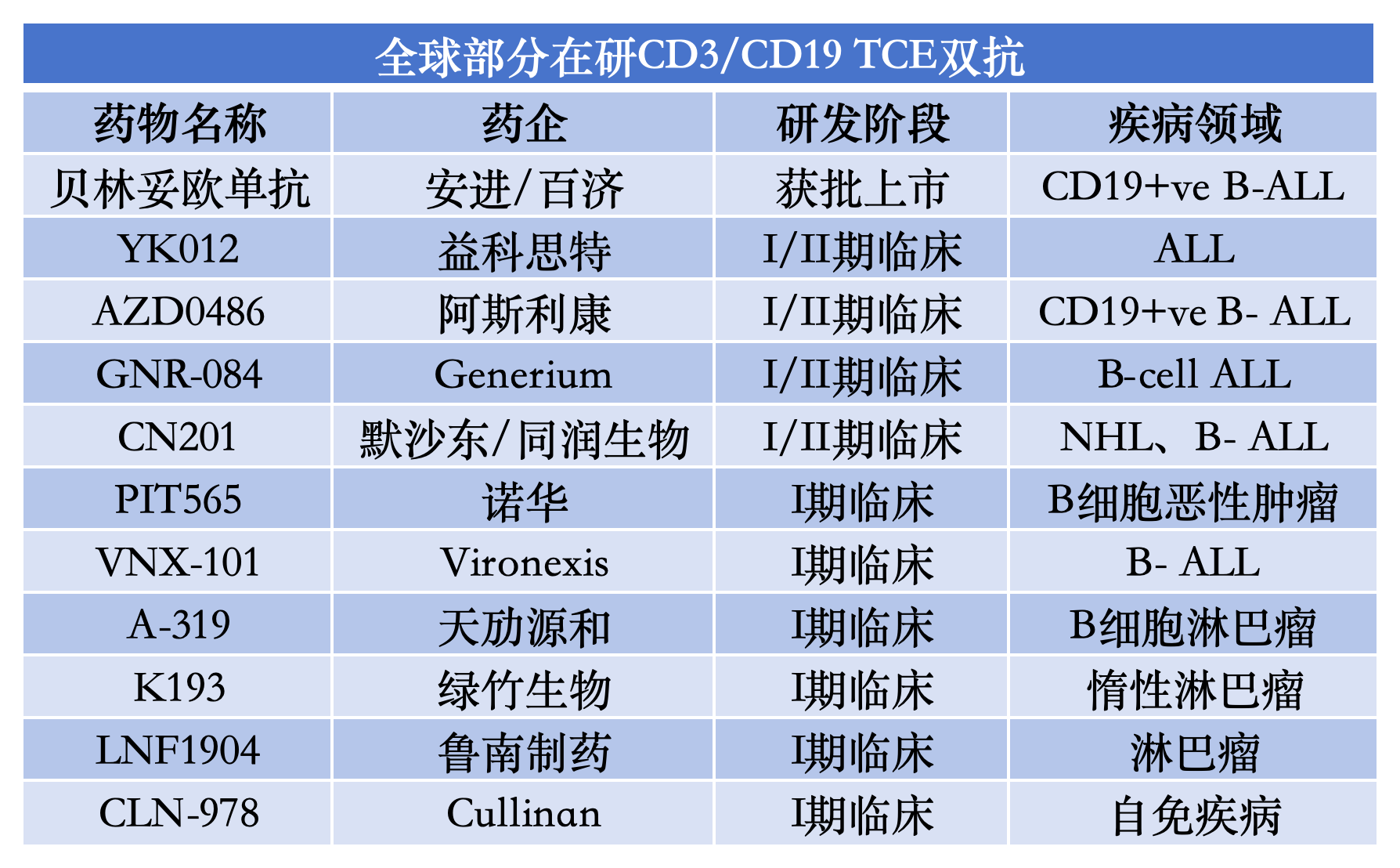
智慧芽新药数据库显示,目前全球在研的CD3/CD19靶向产品超过40款。其中,已处在临床阶段的CD3/CD19 TCE双抗仍有10款,包括同润生物的CN201在内,共有5款产品由国内药企开发。从临床进度来看,益科思特的YK012、天劢源和的A-319、绿竹生物的K193、鲁南制药的LNF1904均排在开发前列。其中是否还能诞生像同润生物CN201的高价授权大药,犹未可知。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx