一场围绕体重管理的市场大战在国内正式打响。
6月25日,国家药监局官方信息显示,诺和诺德公司研发生产的用于长期体重管理的司美格鲁肽注射液新产品正式在中国获得批准。
据悉,该款用于肥胖治疗的司美格鲁肽新产品在中国的商品名为“诺和盈®”,这是全球首个且目前唯一用于长期体重管理的胰高糖素样肽-1受体激动剂(GLP-1)周制剂,此次获批的适应证是针对超重和肥胖症患者,初始体重指数(BMI)符合以下条件的患者可使用该药物:BMI ≥30kg/m²(肥胖),或BMI在27~30kg/m²之间(超重)且存在至少一种体重相关合并症,如高血糖、高血压等,一周一次给药。
据《医药经济报》采访了解,诺和诺德方面已经按照计划正式启动了诺和盈®产品的供应相关流程,以期尽快将这一重磅产品带入中国市场。
业内人士表示,GLP-1作为代谢赛道的“明星”,愈发得到市场认可;此次诺和盈®正式获批,将再度掀起市场对这一赛道的关注。目前,国内减重市场掀起了一股热潮,有多款国产GLP-1肥胖治疗产品获批上市,分别是仁会生物的贝那鲁肽注射液和华东医药的利拉鲁肽生物类似药,两款药品均于今年7月份获批。
值得一提的是,中国GLP-1市场正掀起一场激烈的竞争。据不完全统计,涉及GLP-1靶点的在研药物,仅在国内至少就有30多款处于临床阶段。华东医药、海正药业、爱美客和恒瑞医药等众多企业都加快布局,努力占据市场份额。
获批体重管理
新“药王”即将登场
在中国,司美格鲁肽肥胖治疗产品在2022年8月登记减肥适应症III期临床。试验旨在评估与安慰剂组相比,每周注射一次的2.4mg司美格鲁肽在超重/肥胖同时患有或未患有2型糖尿病患者中的有效性和安全性。
主要终点为第44周时体重较基线的变化(%)和44周后达到体重减轻≥5%的患者比例。次要终点包括44周后达到体重减轻≥10%,体重减轻≥15%,以及第44周时腰围、收缩压、身体功能评分与身体功能领域评分的变化等。
根据诺和诺德的数据,司美格鲁肽能够实现平均17%(16.8kg)的体重降幅并为患者带来超越减重的多重健康获益,其安全性得到了广泛验证。
值得注意的是,去年3月,司美格鲁肽肥胖治疗产品进一步探索扩大适应症范围,并开启新的临床试验:作为低热量饮食和增加体力活动的辅助治疗,用于初始体重指数(BMI)≥24.0且<28.0 kg/m^2(超重)且伴有至少1种体重相关合并症,或BMI≥28.0且<30.0 kg/m^2(肥胖)有或无体重相关合并症的成人患者体重管理。
与本次获批的产品适应症不同,其减重适应症BMI范围进一步下调,将24.0kg/m^2作为减重适应症的临床试验范围,意味着正常体重之上的超重、肥胖等人群都将可能成为这款产品的潜在人群。对于司美格鲁肽注射液这一款在全球掀起降糖与减重浪潮的现象级产品,国内的减重适应症布局正在悄然提速。
作为GLP-1领域最为畅销的大单品,司美格鲁肽3款产品在2023年共取得了1458.11亿丹麦克朗(212.01亿美元)的销售额,仅次于K药(250.11亿美元)。
根据2024年Q1财报,司美格鲁肽3款产品合计创收422亿丹麦克朗(61.32亿美元),其中司美格鲁肽注射用降糖药Ozempic销售额持续攀升至278.10亿丹麦克朗(40.41亿美元),增速43%;口服降糖产品Rybelsus销售额为50.13亿丹麦克朗(7.28亿美元),同比增长17%;减肥药Wegovy销售额翻倍增长达93.77亿丹麦克朗(13.63亿美元)。
竞争白热化
国内玩家谁能抢先?
司美格鲁肽在中国的核心专利将于2026年3月到期,目前,国内已有多家企业竞相开始司美格鲁肽仿制药的研发与相关产业布局。
值得关注的是,2021年6月,华东医药旗下的中美华东制药有限公司向国家知识产权局递交了司美格鲁肽核心专利的无效申请,认为该专利不满足专利法规定的条件。2022年9月,国家知识产权局判定该专利全部无效。诺和诺德不服此决定,已上诉至法院,目前案件仍在诉讼阶段。
这场专利挑战的背后是GLP-1类药物巨大的市场潜力,华东医药若成功,可能加速国产类似药的上市。
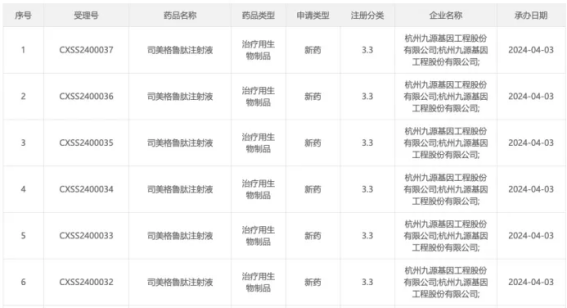
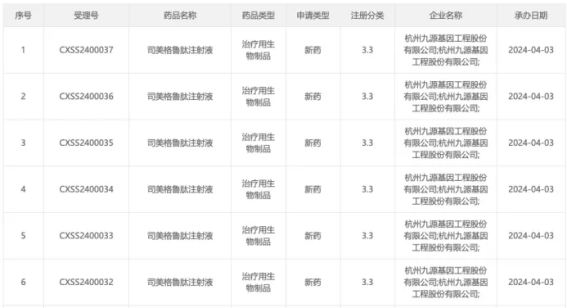
2024年4月,九源基因递交了司美格鲁肽生物类似药的上市申请,成为国内首家报产该药物的企业。其申报的适应症为成人2型糖尿病患者的血糖控制。
招股书揭示了九源基因自1993年成立以来的发展历程,其业务领域主要集中在骨科、代谢病、肿瘤以及血液疾病的治疗。目前,九源基因已经成功将8款产品推向市场,并且拥有超过10款产品正在研发之中。其中,骨科领域的骨优导产品是公司的主要收入来源,但正面临集采的挑战。因此,司美格鲁肽注射液(JY29-2)被寄予厚望,有望成为公司实现业务转型的关键。华东医药通过其全资子公司中美华东持有九源基因21.06%的股份,是其最大股东。
联邦制药是国内较早开展司美格鲁肽减重临床试验的企业之一,2023年4月17日,联邦制药申报的司美格鲁肽注射液获得国家药监局颁发的《药物临床试验批准通知书》,成为国内首家获得该产品减肥适应症临床批件的企业。据CDE公开信息,该公司本次司美格鲁肽临床试验聚焦的适应症是:作为低热量饮食和增加体力活动的辅助治疗,用于肥胖或超重且伴有至少1种与超重相关合并症的成人患者。
在GLP-1受体激动剂这一热门领域,除联邦制药、九源基因/华东医药、丽珠集团/健康元以外,还有众多药企正在展开激烈的研发竞争。包括恒瑞医药、信立泰、甘李药业、华东医药、诺博特生物、双鹭药业、仁会生物等在内的10余家企业纷纷布局,竞相推动各自在研药物向前发展。
作为拥有强大发展潜力的减肥用GLP-1受体激动剂市场,司美格鲁肽注射液新适应症已经获批,后续有望快速抢占市场,各大药企竞争想必更加火热。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx