艾伯维重磅IL-23抑制剂再获FDA批准,治疗溃疡性结肠炎
6月19日,艾伯维(AbbVie)宣布,美国FDA已批准Skyrizi(risankizumab)扩展适应症,用于治疗中度至重度活动性溃疡性结肠炎成人患者。
新闻稿指出,这一批准使其成为首个被批准用于治疗中重度溃疡性结肠炎和中重度克罗恩病的IL-23特异性抑制剂。Skyrizi目前已被批准用于治疗四种免疫介导的炎症性疾病。
Risankizumab是一种人源化、IgG1亚型的单克隆抗体,可以借由与IL-23的p19亚基结合而选择性地拮抗IL-23。IL-23是一种与炎症有关的细胞因子,被认为与许多慢性免疫疾病有关。此前,Skyrizi已获得3项FDA批准的适应症,包括克罗恩病、中重度斑块状银屑病,以及成人活跃银屑病关节炎。
阿斯利康首创AKT抑制剂capivasertib在欧盟获批上市
6月20日,阿斯利康AKT抑制剂capivasertib已在欧盟获批,与氟维司群联合用于治疗雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)、伴有一种或多种PIK3CA、AKT1或PTEN基因突变的局部晚期或转移性乳腺癌成年患者,这些患者在使用基于内分泌的治疗方案后复发或病情进展。 欧盟委员会是根据《新英格兰医学杂志》上发表的III期CAPItello-291试验结果批准该药物的。在该试验中,capivasertib联合氟维司群与氟维司群联合安慰剂相比,可将携带PI3K、AKT或PTEN突变的肿瘤患者的疾病进展或死亡风险降低50%(HR=0.50, 95% CI, 0.38-0.65; p<0.001;中位无进展生存期(PFS)分别为7.3个月 vs 3.1个月)。
欧盟委员会是根据《新英格兰医学杂志》上发表的III期CAPItello-291试验结果批准该药物的。在该试验中,capivasertib联合氟维司群与氟维司群联合安慰剂相比,可将携带PI3K、AKT或PTEN突变的肿瘤患者的疾病进展或死亡风险降低50%(HR=0.50, 95% CI, 0.38-0.65; p<0.001;中位无进展生存期(PFS)分别为7.3个月 vs 3.1个月)。
在CAPItello-291试验中,capivasertib联合氟维司群的安全性与之前评估该组合的试验中观察到的安全性相似。
目前,中国和其他几个国家的监管申请正在审查中。基于CAPItello-291试验,capivasertib与氟维司群联合使用的类似适应症已经在美国、日本和其他几个国家获得批准。
凯思凯迪I类新药CS060304中国IND获批
6月18日,由凯思凯迪开发的具有独立自主知识产权的1类新药CS060304的临床试验申请(IND)获得国家药品监督管理局(NMPA)的默示许可, 此前已于2月在美国FDA获批临床。
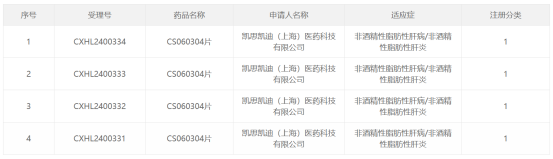 CS060304是一种靶向甲状腺激素受体β(THR-β)的小分子激动剂,旨在用于治疗非酒精性脂肪性肝炎(NASH,又称MASH)患者。同靶点药物MGL-3196(Resmetirom)于2024年3月14日通过加速审批途径获得FDA批准,用于治疗伴中重度肝纤维化的成人NASH患者,是目前获得FDA批准的首款NASH疗法,标志着该领域的一项重要里程碑。
CS060304是一种靶向甲状腺激素受体β(THR-β)的小分子激动剂,旨在用于治疗非酒精性脂肪性肝炎(NASH,又称MASH)患者。同靶点药物MGL-3196(Resmetirom)于2024年3月14日通过加速审批途径获得FDA批准,用于治疗伴中重度肝纤维化的成人NASH患者,是目前获得FDA批准的首款NASH疗法,标志着该领域的一项重要里程碑。
CS060304作用靶点与 MGL-3196相同,是凯思凯迪公司开发的新型THR-β激动剂,高度特异性富集于肝组织。对标Resmetirom,CS060304呈现出积极突出的临床前数据,尤其在NASH小鼠模型中可明显改善NAS评分和纤维化,具有起效剂量低、药效显著且耐受性良好的特点。其临床试验获批有望为NASH患者提供安全有效的潜在治疗的最佳选择,是一种潜在的best-in-class强效选择性THR-β激动剂。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx