辉瑞重磅罕见病用药氯苯唑酸系列产品在国内迎来竞争对手。
日前,齐鲁制药宣布,其研发的神经系统疾病治疗药物氯苯唑酸葡胺软胶囊正式获得上市许可批准,可用于治疗成人转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)I期症状患者,并可有效延缓周围神经功能损害。氯苯唑酸葡胺软胶囊由辉瑞原研,齐鲁制药此番顺利拿下了该产品的国内首仿。

ATTR-PN是一种罕见的、由基因突变而导致常染色体显性遗传的淀粉样变性疾病,常常累及身体多个系统。氯苯唑酸葡胺软胶囊的有效成分氯苯唑酸葡胺是一种转甲状腺素蛋白(TTR)稳定剂,通过选择性地与TTR结合,稳定TTR并减缓其解离成单体的速度,延缓ATTR淀粉样变性的产生和沉积,从而达到治疗效果。
在政策支持和市场导向之下,中国的罕见病药物研发管线在过去五年中以显著的速度增长,预计这一趋势将在未来几年继续保持。其中,开展具有重大社会价值、服务公众的首仿罕见病用药的研制,成为齐鲁制药、正大天晴等本土龙头药企的工作重心。随着更多的研究和投资,未来将有更多的罕见病药物获批上市,加快重塑由原研跨国药企长期把持的市场格局。
国产首家花落齐鲁
辉瑞份额将受蚕食
作为一种罕见的遗传性、进行性加重、致死性疾病,ATTR-PN在30-40岁年龄段多发且不可逆,严重危害患者生存。ATTR-PN的临床主要表现为对称性由肢体远端向近端进展的神经功能障碍,累及运动、感觉及自主神经,并可能伴有心脏、肾脏、眼部等其他脏器受损。在氯苯唑酸出现前,ATTR-PN并无有效的治疗手段。
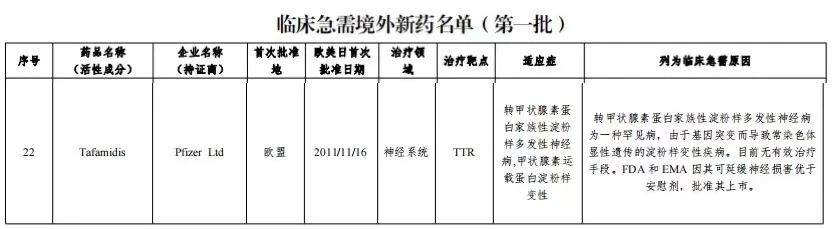
氯苯唑酸葡甲胺(tafamidis meglumine;商品名:维达全,Vyndaqel)是辉瑞开发的一种TTR稳定剂,最早于2011年11月被EMA批准治疗ATTR-PN,用于早期症状性多发神经病的成年患者以延缓周围神经损伤。
大样本长期研究显示,对于ATTR-PN V30M突变的早发型患者,氯苯唑酸葡胺软胶囊与不治疗相比可降低91%的死亡风险,与肝移植相比可降低63%的死亡风险。对于V30M突变的晚发型患者,氯苯唑酸葡胺软胶囊与不治疗相比可降低82%的死亡风险。
2019年3月,Vyndaqel被日本厚生劳动省批准授予SAKIGAKE(领先型,先驱型)药物称号,用于治疗野生型和变异型转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)患者。2019年5月,Vyndaqel和辉瑞开发的另一剂型氯苯唑酸软胶囊(tafamidis;商品名:维万心,Vyndamax)同时被美国FDA批准用于治疗成年人野生型或遗传型ATTR-CM,以降低心血管相关死亡率和住院率,不过两个剂型的推荐使用剂量不同。2019年12月,EMA人用医药产品委员会(CHMP)推荐批准Vyndaqel用于野生型或遗传型ATTR-CM成人患者。
基于突破性疗效,氯苯唑酸在2018年11月被纳入我国第一批临床急需境外新药名单,并通过《接受药品境外临床试验数据的技术指导原则》进行上市申报,在国内豁免临床试验。2020年2月,辉瑞的氯苯唑酸葡胺软胶囊率先获批进入中国市场,用于治疗ATTR-PN I期症状性成人患者,以延缓其周围神经功能损害;同年10月,氯苯唑酸软胶囊也在国内获批用于治疗成人野生型或遗传型ATTR-CM,以减少心血管死亡及心血管相关的住院治疗。
不过,随着齐鲁制药的氯苯唑酸葡胺软胶囊获批上市,辉瑞这一重磅产品在国内市场的份额或将受到蚕食。在辉瑞原研产品于国内上市的当年,齐鲁制药便启动了氯苯唑酸葡胺软胶囊的研发。据悉,齐鲁制药对产品进行科学细致的研究,确保了研究的全面性和完整性,还通过多次生产工艺的优化和试验验证解决产品交联溶出下降问题,从而保障了自制品与原研品体外溶出曲线相似、质量等同,与原研品具有药学和生物等效性。
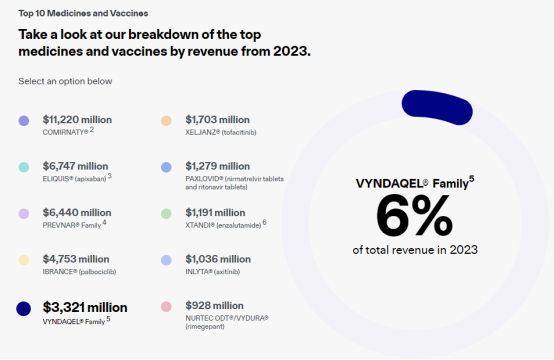
在业内看来,齐鲁制药氯苯唑酸葡胺软胶囊的上市在为ATTR-PN患者带来更大治疗希望的同时,也将大大降低患者治疗的经济负担。2021年8月,辉瑞的氯苯唑酸软胶囊(61mg*30粒)价格从64100元/盒降至24650元/盒,为进入当年国家医保药品目录做好了前期准备;同年12月正式公布的2021年版国家医保药品目录中,氯苯唑酸软胶囊赫然在列。而经过续约谈判,目前辉瑞的氯苯唑酸软胶囊(61mg*30粒)价格已降至16260元/盒。
而氯苯唑酸葡胺软胶囊目前仍未进入国家医保药品目录,随着首仿药获批上市,齐鲁制药或将积极参与今年国家医保药品目录调整,改变这一品种治疗费用不菲的局面。截至目前,齐鲁制药已累计有168个产品通过或视同通过一致性评价,其中57个为国内首家。正如齐鲁制药在这次公告中所言,随着药物可及性的提高,越来越多的患者将得到更加规范的治疗,从而延缓疾病进展、提高生活质量、延长生命周期。
孤儿药仿制成热点
正大天晴接踵而至
罕见病是对一类患病率极低、患者总数少的疾病的统称,全球目前已知的罕见病超过7000种。根据Evaluate预测,全球罕见病药物的市场规模在2024年将达到1850亿美元,到2028年将达到2700亿美元左右。在过去截至2023年的10年时间里,全球罕见病药物的平均销量增长了近11%。随着整个处方药市场的持续增长,罕见病药物的市场也将继续增长。
而在国内,公开数据显示,中国已知的罕见病数量大约有1400余种。由于罕见病常常确诊困难,有大量罕见病被当作普通疾病治疗,或并未发现,实际的病种数量可能更多。据估计,中国的罕见病患者群体已超过2000万,总人数是美国市场的四倍以上且增长迅速。据预测,中国罕见病药物市场在全球市场中的份额,将由2020年的约1%增加至2030年的约7%。
伴随着鼓励仿制药目录、罕见病目录等系列政策的深入推进,面对未被满足的临床需求和前景广阔的市场潜力,本土药企在中国罕见病治疗领域开始逐步发力。在2023年国内获批上市的45个罕见病治疗药物中,多达18款产品为本土药企研制,共涉及13种罕见病领域。除去2款为剂型/规格调整之外,新药和仿制药的数量均达到了8款。
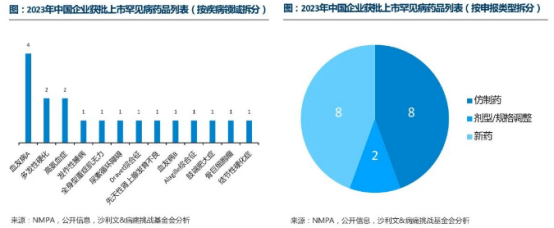
对已上市罕见病药物进行仿制是提高患者药物可及性的重要手段。近年来,国内药企除引进或自主研发罕见病药物外,还积极对已上市罕见病药物进行仿制。据统计,《鼓励仿制药品目录》中的6种罕见病药物,其中4个品种的仿制药已在近1-2年内获批上市。
而看中辉瑞氯苯唑酸这一重磅产品的不只有齐鲁制药。2023年2月,在齐鲁制药报产氯苯唑酸葡胺软胶囊后不到一个月的时间,南京正大天晴也接棒提交了氯苯唑酸葡胺软胶囊的4类仿制上市申请,并获得CDE承办,和齐鲁制药共同冲击该品种的国内首仿。随着齐鲁制药的氯苯唑酸葡胺软胶囊已于近日获批生产,率先拿下该品种首仿,南京正大天晴的相关产品或也获批在即。

此外,仁合益康旗下的石家庄科仁医药在2024年4月也完成氯苯唑酸葡胺软胶囊的人体生物等效性(BE)试验,如果试验结果没有问题,其或也将择期申请该产品的上市。
值得一提的是,对于辉瑞而言,其在面对中国本土药企即将展开的氯苯唑酸葡胺软胶囊围攻战的同时,也正在受到全球创新药上市的影响。目前,全球有多种类型的TTR靶向疗法处于活跃研发阶段,除了辉瑞开发的小分子药物氯苯唑酸系列产品外,包括反义寡核苷酸疗法、siRNA疗法、基因编辑疗法、抗体疗法等在内的创新疗法皆在快速推进当中。
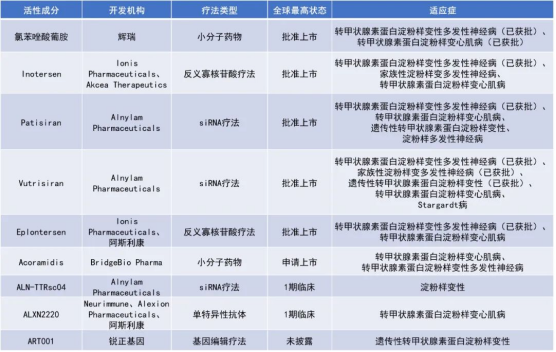
2023年12月,阿斯利康和Ionis Pharmaceuticals联合开发的每月一次、可由患者自己皮下注射的反义寡核苷酸(ASO)疗法Wainua(eplontersen)获得美国FDA批准上市,用于治疗成人遗传性ATTR-PN,这也是首个可通过自动注射器自行给药用于治疗ATTR-PN的获批药物。此前,Ionis Pharmaceuticals开发的每周一次的皮下注射针剂、ASO疗法Tegsedi(inotersen)已在美国上市,也用于治疗遗传性ATTR-PN。
此外,Alnylam开发的全球首款siRNA药物Patisiran(onpattro)和全球第五款siRNA药物Vutrisiran(amvuttra)亦先后获批上市,适应症同为成人遗传性ATTR-PN。Vutrisiran作为Patisiran的迭代药物目前正在向ATTR-CM等适应症加快拓展,也是辉瑞氯苯唑酸系列产品的有力竞争者。而阿斯利康旗下Alexion与BridgeBio Pharma联合开发的小分子药物Acoramidis也同样备受期待,其用于治疗ATTR-CM患者的新药上市申请已于2023年12月提交。
可以预见的是,辉瑞在转甲状腺素淀粉样变性疾病领域一家独大的局面将很快难以为继。尤其是随着国内罕见病支持政策的持续推进,将会有更多本土企业布局罕见病领域,进一步推动罕见病领域药物上市。在罕见病治疗药物上市数量大幅增加的趋势下,更多罕见病患者将不再无药可治,能够切实从中受益。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx