围绕泊马度胺胶囊这款重磅潜力品种的市场抢夺战,硝烟已经开始燃起。
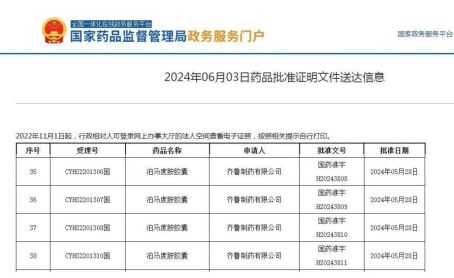
日前,据国家药品监督管理局官网公示,齐鲁制药抗肿瘤药物泊马度胺胶囊正式获得上市许可批准。
泊马度胺(Pomalyst/Imnovid)是百时美施贵宝(BMS)旗下新基开发的一种沙利度胺类似物,属于免疫调节剂类药物。原研药由新基公司开发,于2013年2月获FDA批准上市,同年8月在欧洲获批。不过,该药并没有第一时间进入中国市场。
事实上,泊马度胺胶囊是典型的仿制药先于原研药获批上市的案例。在国内市场,首家产品上市企业是正大天晴,于2020年11月获批首仿。2022年6月份,原研百时美施贵宝(新基)也提交了泊马度胺胶囊的上市申请。未来几年,泊马度胺作为多发性骨髓瘤的仿制热门药之一,市场竞争会越来越激烈。
拿下超30亿大品种齐鲁国产第二家
多发性骨髓瘤(Multiple Myeloma, MM)是一种克隆性浆细胞异常增殖的恶性疾病,是血液系统常见的恶性肿瘤之一。目前,我国多发性骨髓瘤发病率已超过急性白血病,成为血液系统第二大恶性肿瘤。
近年来,随着医药科技的飞速发展,泊马度胺作为继第一代沙利度胺、第二代来那度胺之后的第三代免疫调节剂药物,显示出独特的抗感染、免疫调节、抗肿瘤增生、抗肿瘤血管生成等作用,并展现出其在多发性骨髓瘤治疗中的独特价值,尤其在针对难治复发性多发性骨髓瘤的临床试验中显示出良好的疗效和更低的毒副作用。
临床数据表明,泊马度胺对新诊断的复发难治性骨髓瘤的治疗有较高的缓解率,并且在后续的维持和巩固治疗中能够显著延长临床患者的无进展生存期和总生存期,对来那度胺和硼替佐米均难治的患者,泊马度胺也显示出令人信服的疗效。
2013年2月,泊马度胺率先获FDA批准上市,用于治疗已经接受至少两种疗法(包括来那度胺和蛋白酶体抑制剂)并在最后一次治疗期间或治疗结束后60天内发生疾病进展的多发性骨髓瘤患者。同年8月,该适应症在欧盟获批。2020年5月,泊马度胺在美国扩展新适应症,用于治疗卡波西肉瘤,成为针对该疾病的首个口服药物。
自上市以来,泊马度胺销售额持续增长。从2013年的3.05亿美元快速增长至2018年的20.4亿美元,首次突破20亿大关,给BMS带来了不错的收益。
据BMS财报,泊马度胺2023年全球销售额为34.41亿美元。同时,米内网数据显示,2023年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端泊马度胺胶囊销售额接近2亿元,同比增长44.02%。
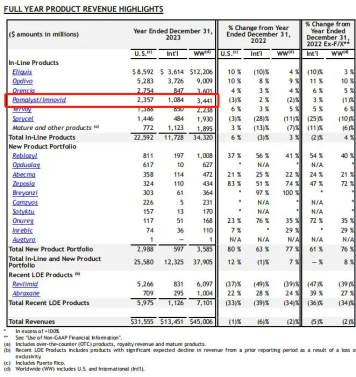
值得一提的是,泊马度胺的“兄弟”——MM二代药物来那度胺已成长为百亿美元品种,也是目前全球最畅销的药物之一,在2021年全球畅销肿瘤药物排行第2位,销售额达128.2亿美元,仅次于K药。目前,泊马度胺一般作为来那度胺治疗的补充,主要适用于来那度胺无效或者耐药的情况,另外,在适应症的广度上,泊马度胺也有待进一步开发。
齐鲁制药自2013年立项研发泊马度胺胶囊,2022年8月16日提交新药申请,并获得CDE受理。此次获批的泊马度胺胶囊涵盖4种临床使用规格,相比国内现有的泊马度胺胶囊,新增2mg、3mg两个规格,更适合于轻度至重度的肝肾功能损害患者,剂量调整更方便。
同时,根据一项全国人口分析研究,从2012年到2016年,中国MM的患病率和发病率分别为5.68/10万人和1.60/10万人,因此泊马度胺在中国有巨大的临床需求。尽管目前已有一款国产泊马度胺上市,临床和市场仍存在诸多未被满足的需求。
仿制药开发备战踩准快速放量期
据CDE官网,目前国内已有多家企业布局泊马度胺胶囊市场。
正大天晴药业集团于2018年7月率先提交了泊马度胺胶囊的上市申请,品规为1mg及4mg,同年10月被纳入优先审评程序,2020年11月拿下首仿+首家过评。
值得一提的是,泊马度胺胶囊在2021年的医保谈判中顺利进入医保药品目录,也成功续约2023年版国家医保药品目录(乙类)。
米内网数据显示,正大天晴药业集团的泊马度胺胶囊“入保”后迎来了一波销售放量,2022年该产品在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端的销售额超过了1.3亿元,增长率达到648.30%。从销售渠道来看,城市公立医院占比超过80%,县级公立医院占比在15%左右。
2020年,扬子江药业提交的3类仿制药——泊马度胺胶囊获得2项临床默示许可,适应症为:与地塞米松联用,用于治疗既往接受过至少两种药物(包括来那度胺和硼替佐米)治疗且被证实疾病进展或末次治疗完成60天内的成年多发性骨髓瘤患者。
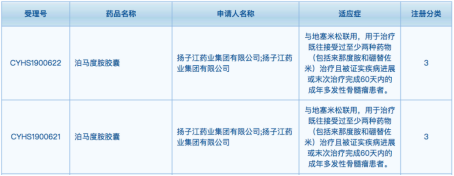
此外,在国内本土制药企业仿制药的开发备战中,以仿制品种注册申报的企业有江苏豪森药业、江苏先声药业、江苏奥赛康药业、南京华威医药、南京卡文迪许生物、合肥久诺医药、河北国龙制药、石家庄四药、合肥信风科技、江苏嘉逸医药、北京福瑞康正医药、北京科莱博医药、杭州和泽医药、大丰迪赛诺制药、上海创诺制药、齐鲁安替制药等。
据统计,2020年全球新发MM病例约17.6万,占全球新发癌症病例的1%。另外,据弗若斯特沙利文和Kantar Health统计,2021年美国、中国、欧洲五国和日本这四大市场的MM患病人数分别约为14.8万、12.6万、12.2万和2.8万人。
随着人口增长及老龄化趋势,加上早期较为有效的治疗方法和新药物的应用,患者生存时间显著延长,中国将成为接下来十年内患者数增加最快的国家,年复合增长率高达8%,到2030年患病人数有望增长到26.6万人,成为全球最大的MM患者市场。
据测算,从2017开始,全球8个主要国家(美国、欧洲G5、中国和日本,8MM= 8 major markets)的MM市场已接近150亿美元,预计将以6.7%的年复合增长率增长,在2027年有望达到278亿美元。其中,中国MM市场将从2017年的6.7亿美元增长到2027年的41.4亿美元,年复合增长率高达20.3%。
从临床适应症开发来看,骨髓纤维化、脑癌、硬皮病等适应症已进入临床开发,未来如若获批,对泊马度胺的市场开拓将带来更大利好。国内品种注册申报方面,泊马度胺得到了极高的青睐,近20家企业对此品种进行了仿制,国内市场的争夺早已正面开启,相信该品种未来的国内市场,会有一定程度的利好表现。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx