药品专利纠纷早期解决机制确立和制度落实,不仅在维护专利权人合法权益,促进医药产业高质量发展方面发挥了重要作用,同时在降低仿制药侵权风险,提升研发效率和药品可及性,提供了制度保障。
近日,中国裁判文书网公开了多份有关赛诺菲在特立氟胺知识产权纠纷案件的中国二审行政判决书(简称《行政判决书》)和二审民事裁定书(简称《民事裁定书》):(2023)最高法知行终1030号,(2023)最高法知行终1031号,(2023)最高法知民终2469号。
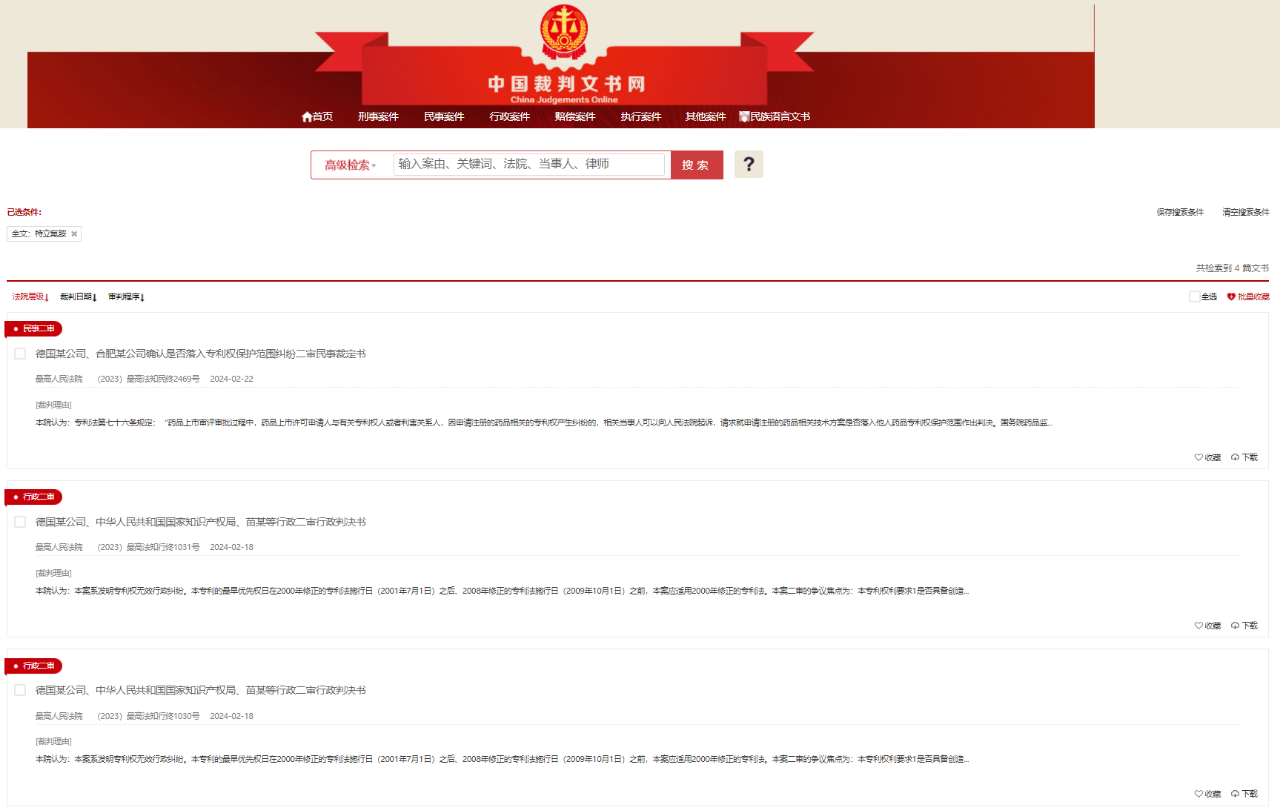
据《行政判决书》和《民事裁定书》内容显示,德国某公司即赛诺菲-安万特的德国公司(Sanofi-aventis Deutschland GmbH),其拥有的专利号为ZL201510052299.X和ZL201510052300.9发明专利,于2021年7月被宣告专利权全部无效。对于一审结果,赛诺菲并不想轻易放弃,在上诉过程中,赛诺菲对专利权无效试图最大程度挽回,更对“先行裁驳、另行起诉”提出异议。不过,在今年2月份的终审当中,结果没有能够扭转专利无效判决,一审起诉仿制药企业侵权被驳回的判决也维持了原判。

本次专利权纠纷,赛诺菲对于一审被告合肥恩瑞特药业有限公司(简称“恩瑞特”)发起的知识产权侵权诉讼,尤为引人关注。资料显示,在一审过程中,赛诺菲方面认为受理号为CYHS2300509、规格为14mg的特立氟胺片的技术方案落入了其专利保护范围。据《医药经济报》新媒体中心记者查询公开信息,“CYHS2300509”受理号正是恩瑞特提交的特立氟胺仿制药上市申请。
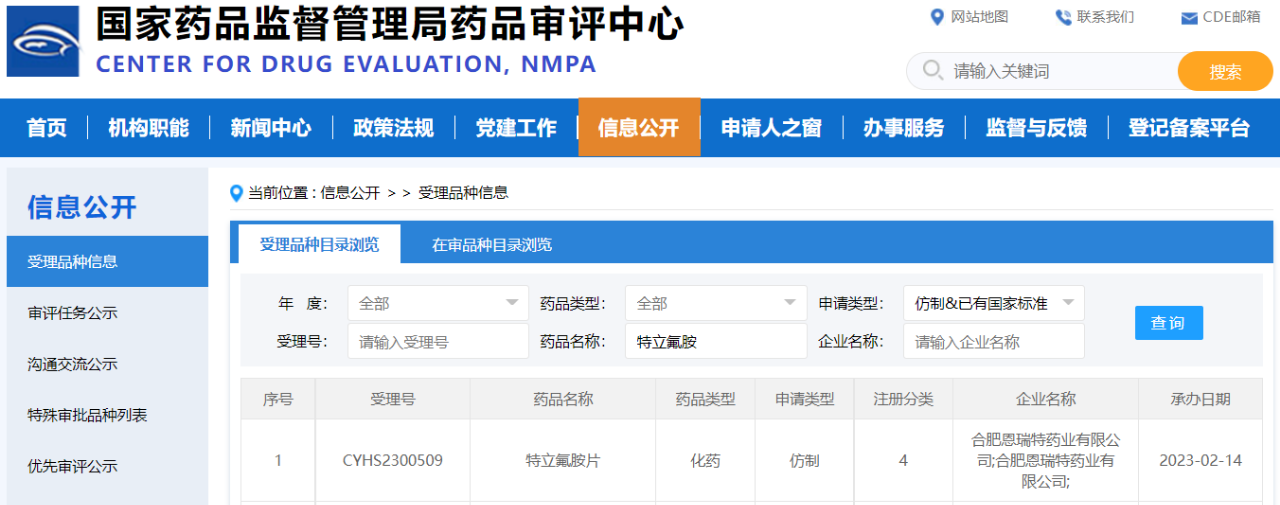
事实上,早在2022年1月,盛世泰科的4类仿制药特立氟胺片获批上市并视同过评,成为国内首仿,极大丰富了临床用药选择。此后,辰欣药业和恩瑞特陆续提交特立氟胺片4类仿制药上市申请。国产替代全面加速,相关原研专利被无效,意味着赛诺菲的明星重磅原研产品“奥巴捷®”在国内市场将可能面对更大的仿制药竞争压力。
特立氟胺是赛诺菲的明星产品。2012年9月,该药在美国被批准用于治疗成人复发型多发性硬化(商品名为Aubagio),2013年9月该药在欧盟批准用于治疗成人复发-缓解型多发性硬化。
2018年5月,多发性硬化症(MS)被纳入中国《第一批罕见病目录》,该病属于一种终身、慢性、进展性疾病,是目前全球最常见的青壮年致残性神经系统疾病之一。2018年7月,奥巴捷®(特立氟胺片)被批准在中国上市,第二年该药经过医保谈判顺利纳入国家医保目录,2020年被NMPA批准用于治疗临床孤立综合征(CIS)。
就在赛诺菲加大力度希望奥巴捷®在临床市场更上一层楼,2020年10月,自然人苗某分别针对ZL201510052299.X和ZL201510052300.9两项专利提起无效请求。次年7月份,北京知识产权法院对两项专利相继以不符合专利法第22条第3款的规定为由被宣告专利权全部无效。

对于两项专利无效的结果,赛诺菲向一审法院(北京知识产权法院)提起行政诉讼,请求撤销该审查决定并判令国家知识产权局重新作出审查决定。2023年7月,一审法院作出(2022)京73行初1630号、(2022)京73行初1631号行政判决,驳回了赛诺菲的诉讼请求。
赛诺菲随即继续向最高人民法院上诉,而在此次《行政判决书》中,围绕ZL201510052299.X和ZL201510052300.9两项专利纠纷,最高人民法院于2023年11月立案,并于2024年1月对本案进行询问,最终裁定认为:一审判决认定事实清楚,适用法律正确,应予维持。
赛诺菲选择这个节点向恩瑞特发起“专利战”,似乎也有着很大的竞争压力。据本次公布的《民事裁定书》信息显示,赛诺菲向一审法院提起诉讼,请求确认恩瑞特申报的规格为14mg的特立氟胺片的技术方案落入专利号为201510052300.9的发明专利保护范围。
不过,一审法院正是基于2021年7月国家知识产权局宣告涉案专利权全部无效,于2023年9月25日作出的(2023)京73民初493号民事裁定,驳回了赛诺菲的诉讼请求。主要依据在于,按照专利法规相关要求:“权利人在专利侵权诉讼中主张的权利要求被国务院专利行政部门宣告无效的,审理侵犯专利权纠纷案件的人民法院可以裁定驳回权利人基于该无效权利要求的起诉。”

赛诺菲不服一审裁定,向最高人民法院提起上诉,请求:撤销一审裁定,指令一审法院继续审理本案。事实和理由为:(一)涉案专利权仍处于有效状态,一审裁定参照适用有关“先行裁驳、另行起诉”的规定缺乏正当性。(二)对本案进行实体审理的处理符合专利权人和仿制药申请人利益的合理平衡。
不过,本次公布的《民事裁定书》内容显示,可以起诉的纠纷是因申请注册的药品相关的专利权产生的,如果不存在合法有效的专利权,则该类纠纷不具备审理的基础。按照此前的判决结果,赛诺菲涉案专利权自始无效,因此在最高人民法院二审,赛诺菲起诉恩瑞特的条件同样不具备。终审裁定认为:上诉请求不能成立,应予驳回,维持原裁定。
此外,对于“先行裁驳”,最高人民法院明确:审理权利人或利害关系人提起的确认是否落入专利权保护范围纠纷之诉,在涉案专利权被国家知识产权局宣告无效,但宣告专利权无效的审查决定尚未确定发生法律效力的情况下,可以先行裁定驳回原告的起诉。一审法院先行裁定驳回赛诺菲的起诉亦无不当。
奥巴捷®(Aubagio)是赛诺菲开发的一种口服嘧啶合成酶抑制剂和免疫调节剂,主要通过抑制二氢乳清酸脱氢酶阻止淋巴细胞中嘧啶的合成。
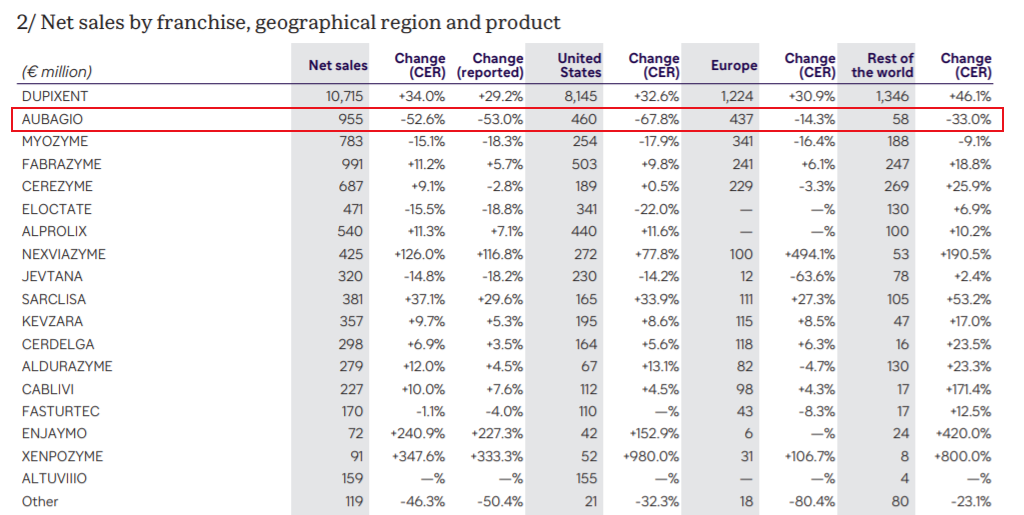
据赛诺菲财报,在2023年之前,Aubagio在赛诺菲的产品管线中是当之无愧的重磅产品,自2017年实现超过15亿欧元的销售额之后,Aubagio的销售额径直奔向20亿欧元,并连续多年维持在高位。
事实上,Aubagio在美国的专利纠纷,同样激烈。由于仿制药的冲击,2017年赛诺菲就因专利US8802735B2提起了多起诉讼,被告涉及Breckenridge Pharmaceutical Inc,Mylan Pharmaceuticals Inc,MSN Laboratories Private Ltd,Hetero USA Inc,Zydus Pharmaceuticals (USA)Inc,Amneal Pharmaceuticals LLC,Par Pharmaceutical Inc等,最终上述诉讼多以“和解”收尾。直到2023年,BIOCON PHARMA以及HETERO LABS LTD V的特立氟胺仿制药才在美国正式获批。
恰恰是在2023年,赛诺菲的Aubagio销售额大幅“跳水”,全年仅收获9.55亿欧元。主要原因正是专利到期,产品失去市场独占权,以及新型MS药物的获批上市,市场销售遭遇激烈竞争。
目前,MS无法治愈,只能通过急性期激素冲击治疗和疾病修正治疗(DMT),控制炎症反应,抑制免疫细胞活性,从而达到减少复发次数、延缓病情进展、改善预后的目的。截至目前,全球已经批准多款DMT药物如芬戈莫德、富马酸二甲酯、西尼莫德和奥扎莫德等。
在中国市场,聚焦这款罕见病治疗潜力产品,国内药企在特立氟胺布局方面动作积极,研发注册正在全面加速。
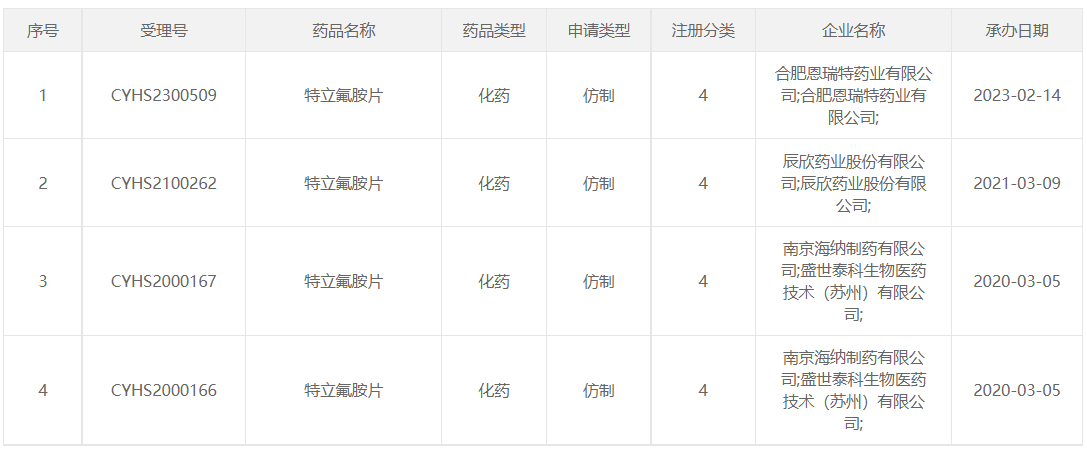
2020年3月5日,南京海纳制药和盛世泰科联合申报的4类仿制药特立氟胺片上市申请获CDE受理承办,成为国内首个提交特立氟胺仿制药上市申请的企业。2022年1月5日,盛世泰科的4类仿制药特立氟胺片获批上市并视同过评,为国内首仿。

2021年3月9日,辰欣药业4类仿制药特立氟胺片的上市申请获受理承办,这是继海纳制药 /盛世泰科之后,国内第二家特立氟胺仿制药报产。
2023年2月14日,恩瑞特4类仿制药特立氟胺片的上市申请获受理承办。
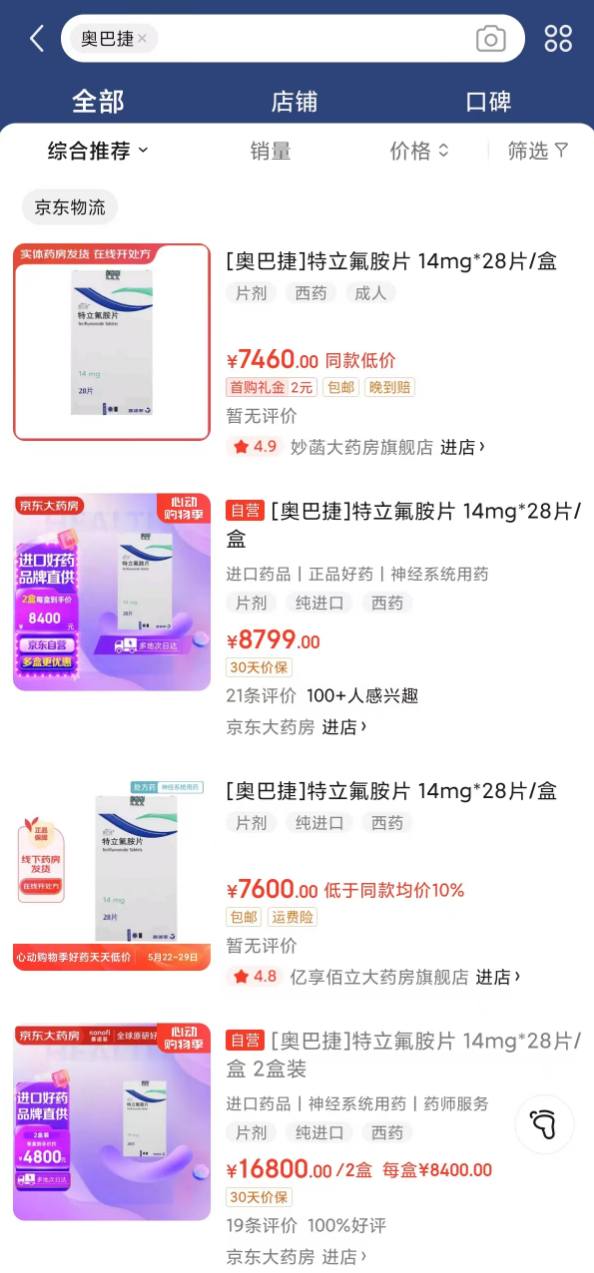
线上购药平台信息显示,原研奥巴捷®特立氟胺片14mgx28片/盒的售价,约在8000元/盒左右。相较于该产品曾经超过万元/盒的价格,已经有明显下降。随着国产药物逐渐上市,国产替代将进一步提升多发性硬化症治疗药物的可及性。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx