9月,CDE发布关于公开征求《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》意见的通知,沉睡已久的审查规定再次被提起。
其中,最重磅的修订是“自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请。”
如何赶上“过评的末班车”,成为了药企不得不面对的问题。
01
未过评,就出局
对存量仿制药“出重拳”
《征求意见稿》是在之前一致性评价相关文件以及在实施过程中收集的共性问题基础上的处理原则,对一致性评价受理审查指南进行修订。
文件分为适用范围、资料接收/受理部门、资料基本要求、形式审查要点、接收/受理审查决定、其他以及附件七大部分。
其中,最重磅的政策是:自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请。
这一次的变动,不是不注册的问题,而是直接不再受理一致性评价的申请。
但也并非一刀切。比如对属于临床必需、市场短缺的药品,可提出延期评价申请。
企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请,经省级药品监管部门会同卫生行政部门组织研究认定后,可予适当延期;
另外一种延期的情形是,境外生产药品或港澳台生产医药产品,可向国家药品监管部门提出延期评价申请。
本次《征求意见稿》主要“出重拳”的是存量仿制药,新3/4类化学药视同过评这一政策本次意见稿未变。
细细追溯,本次的重磅政策,其实不是首次提起。早在2016年,国家药监局印发《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(2016年第106号)的公告就有提及。
其中,第一条(二)、(三)款要求如下:
第(二)款:凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价。
第(三)款:上述第(二)款以外的化学药品仿制药口服固体制剂,企业可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请。
彼时无奈放弃、等待拖堂的药企比比皆是。
然而,2017年,全国仅有15个品种通过一致性评价,2018年仅有82个通过,加起来不足100个。
02
未过评品种,
末班车时间已然不多
然而,《征求意见稿》出台后,无药可用的问题逐渐显现。
无奈之下,国家药监局于2018年年底印发《关于仿制药质量和疗效一致性评价有关事项的公告》(2018年第102号)。
第二条第(二)款“化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。”
逾期未完成的,企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请,经省级药品监管部门会同卫生行政部门组织研究认定后,可予适当延期。逾期再未完成的,不予再注册。
相对于“首家3年后关门”变成了“首家3年后批条子”。
另外,新版基药目录《国家基本药物目录(2018年版)》出台,建立动态调整机制,通过一致性评价的品种优先纳入目录,未通过一致性评价的品种将逐步调出目录。但是对纳入基药的品种,不再统一设置评价时限。
顺着这两个台阶,2019年起过评的品种数逐年上升。据药智数据显示,目前已累计通过品种(不含视同通过)超过800个。若从品规上测算,一致性评价过评品规(不含视同通过)已经超过3500个。
从这些年的集采、一致性评价政策实施的轨迹也可看出,行业内对一致性评价和集采基本已形成一个动态平衡。
国家集采也顺利实施八批九轮,马上即将开展第九批集采。
相比于部分省份温和的“未过评品种就会暂停采购”政策,在“放水”快5年之际,这一次《征求意见稿》,又把过评时限要求重新拿出来,从产品端发力,着力清退大量同质化的产品。
这一次,很可能就是动真格对大量“老批文”清洗,给“陈旧”批文敲上警钟。
未过评的品种,剩余的末班车的时间,已然不多。
03
涉及上千家品种,
仿制药过评情况分析
虽然这几年国内企业大有加速过评的趋势,成效也基本显示出来,但是距离大部分品种都能“活下去”,路还很长。
据公开数据统计,截至2022年我国化学药批文总数累计超过9万个,其中独家批文数不到1万,同一药品批文中超过3家的占比超过90%。
超过3家批文中,涉及的药品品种测算至少有4000种。
目前,国内过评的药品品种约800个,除去个别独家和仅有2家批文的,目前超过三家批文的平均过评比例大概仅有五分之一。
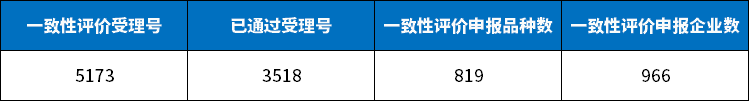
有个别品种处于红海竞争局面,像盐酸氨溴索注射液、利伐沙班片、他达拉非片、阿莫西林胶囊等品种,过评数量超过50个。
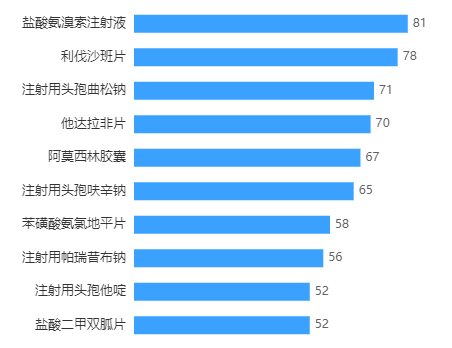
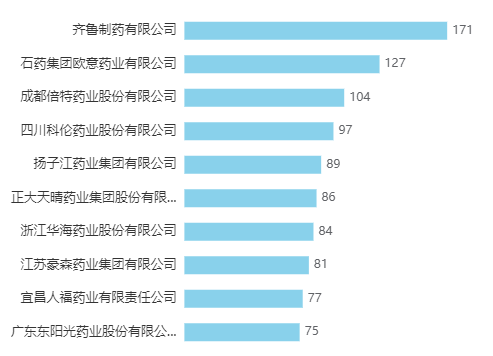
扣除掉这些红海品种影响,实际上的一致性评价整体推进效率还不算特别高。
实际下场参与的企业中,排名靠前的企业是齐鲁、石药欧意、成都倍特、四川科伦等。
04
小结
本次《征求意见稿》的发布,给仿制药企业们敲了一个警钟:手上还未开展一致性评价,但已有其他企业过评的品种,要抓紧了。
一致性评价和集采是大势所趋,来临只是时间问题,企业只能积极面对,无法逃避。
特别是,以大宗仿制药为主的企业,除了认真参与“一致性评价”和“带量采购”,别无他法。
时代在变,政策在变。规则不断优化,行业深化洗牌……这些是一致性评价带来的变化,药企要做的,就是不断适应变化。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx