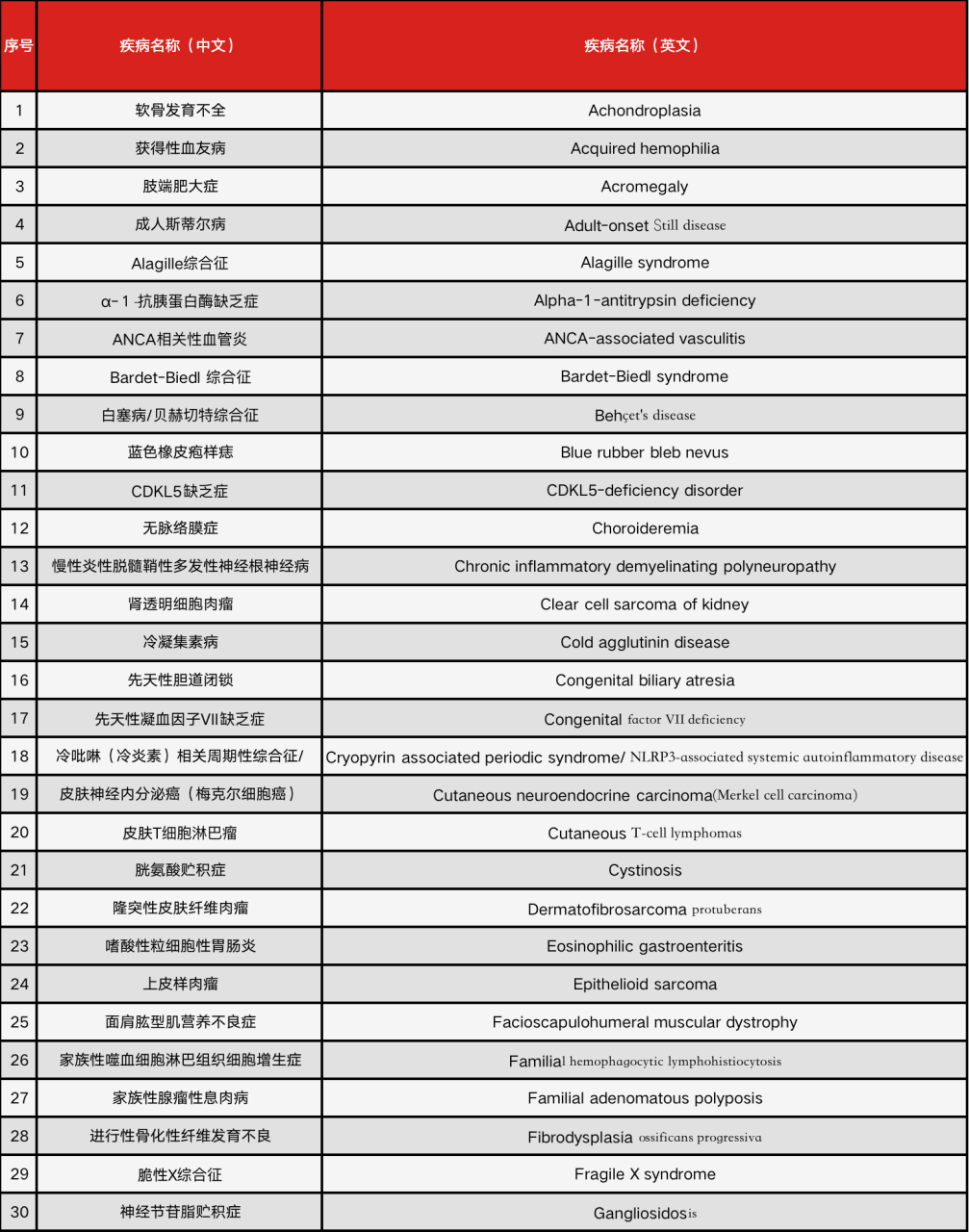
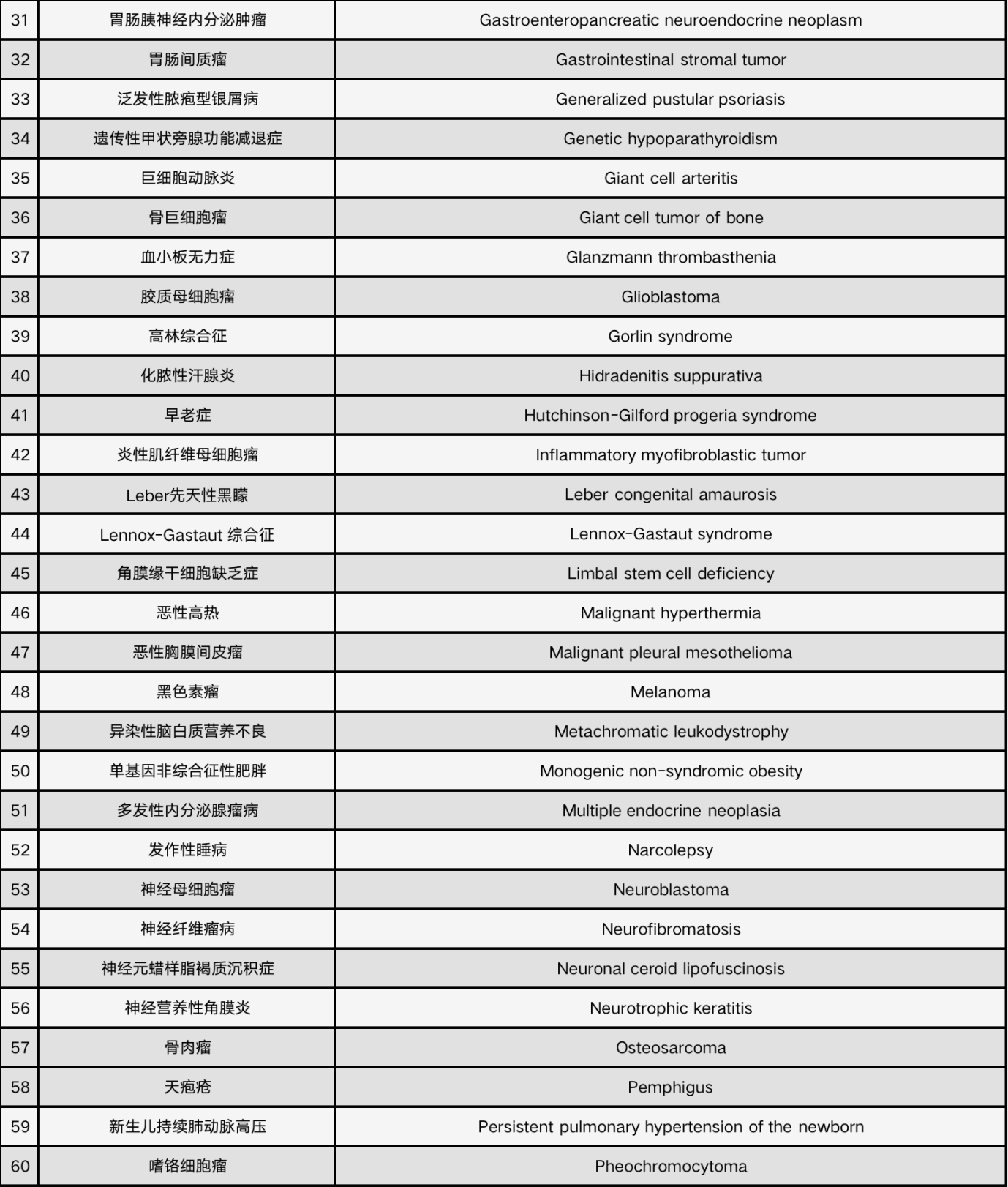
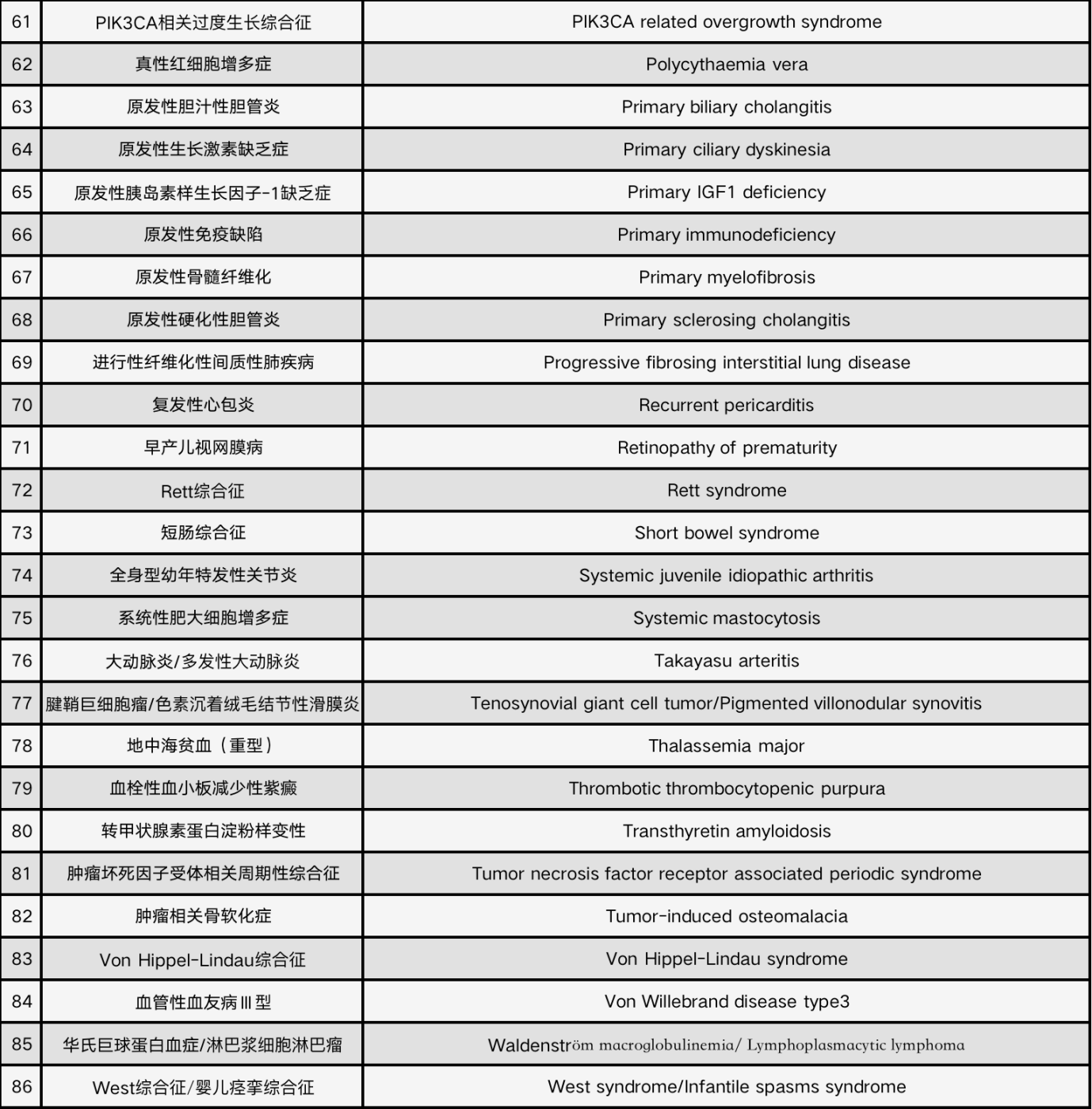
9月20日,卫健委等六部门联合发布《第二批罕见病目录》,共纳入86种罕见疾病,包括获得性血友病、肢端肥大症等被纳入其中。
2018年发布的《第一批罕见病目录》共纳入121种个病种,也就是说,目前我国共有207种罕见病。
随着监管日渐重视罕见病管理,未来罕见病在国内将得到更好的管理和治疗。这对于患者、医生、药企,都是一件好事。
/ 01 /
罕见病需要被定义
罕见病患者群体需要被定义。
根据世界卫生组织的定义,患病人数占总人口0.65‰—1‰的疾病,即可被定义为罕见病。不过,世界各国对罕见病的认定标准有较大差异。
例如,美国对罕见病的定义为,患病人数少于20万人的疾病;欧洲的定义为,发病率低于5/100000的疾病。
国内对罕见病的定义,则是基于《罕见病目录》。2018年5月,国家卫健委等五部门联合印发《第一批罕见病》目录,共涉及121种罕见病。
这是一个好的开端,只不过仍有很多罕见病,在国内缺乏基础的流行病学数据,患者诊疗之路困难重重。根据中国罕见病联盟对20804名患者的调查,42%的罕见病患者曾被误诊。
很显然,罕见病群体需要得到更大的覆盖。此次,随着《第二批罕见病目录》的出台,我国被定义的罕见病数量将增长至207种。
这无疑会提高国内罕见病的诊疗能力。
/ 02 /
迎接罕见病药物的春天
实际上,在较大的人口基数下,罕见病其实并不罕见,全球罕见病患者群体规模已超过7000万人;罕见病药物的市场规模也不“渺小”,2020年达1351亿美元。
只不过,在国内,罕见病药物还只能算是一个潜在的蓝海市场。
尽管目前我国现有2000万多罕见病患者,每年新增患者超过20万,但受限于支付环境等诸多因素,罕见病药物市场尚未爆发。2020年,国内这一市场规模仅有13亿美元,国内罕见病研发力量也较为薄弱,入局的北海康成等药企,目前在资本市场均受到了冷落。
好的一点是,这两年,监管层通过对罕见病药物实施优先审评审批、鼓励药企投入创新研发等政策措施,破解罕见病患者用药难题,罕见病药物研发的春天也正在一步步向我们走来。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx