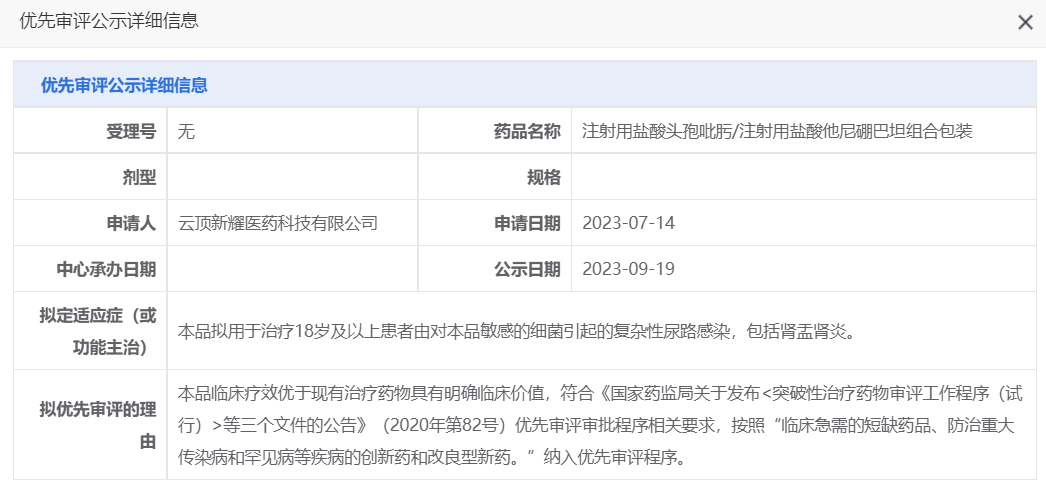
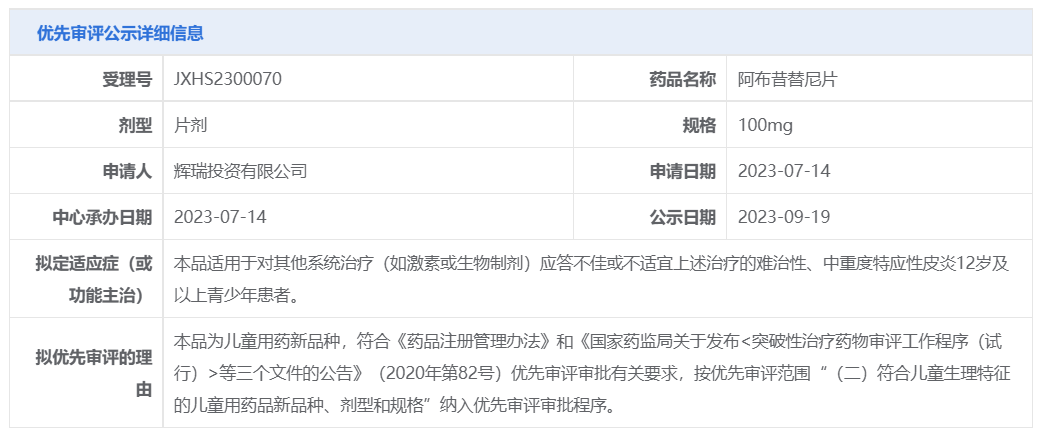
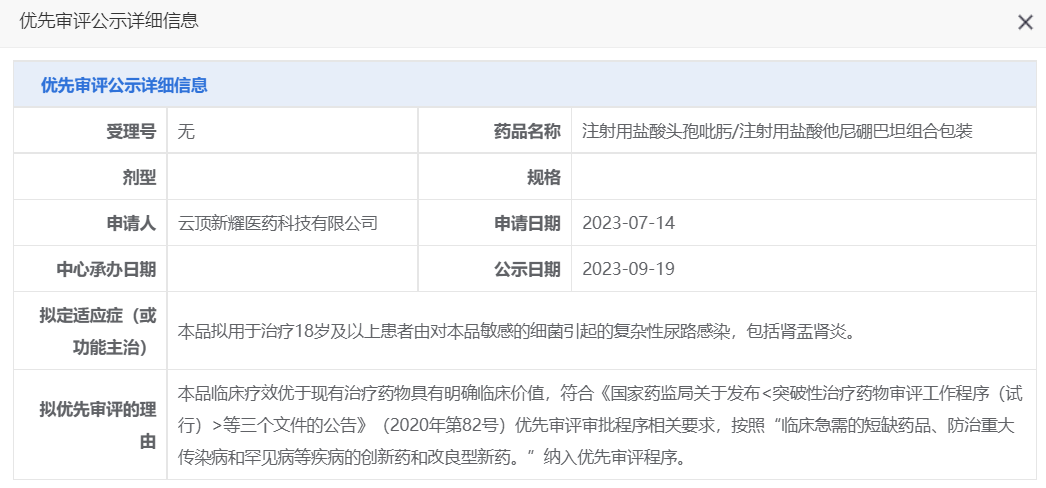
9月19日,CDE将辉瑞的阿布昔替尼片、云顶新耀的注射用盐酸头孢吡肟/注射用盐酸他尼硼巴坦组合包装纳入拟优先审评品种名单。
1.阿布昔替尼片
阿布昔替尼片是一种每日一次口服的JAK1选择性抑制剂,于2022年1月获FDA批准上市,紧接着在2022年4月获NMPA批准上市,用于治疗中度至重度特应性皮炎成人患者。
据CDE官网显示,本次阿布昔替尼片拟纳入优先审评的适应症为:对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎12岁及以上青少年患者。此外,阿布昔替尼片的“拟优先审评的理由”为儿童用药新品种。
特应性皮炎是一种慢性、复发性、炎症性皮肤病,多发于幼儿早期、儿童期,甚至持续至成年,具有明显的年龄阶段特征,最基本的特征为皮肤干燥、湿疹样皮损和剧烈瘙痒等。特应性皮炎的全球发病率持续呈上升趋势,人群发病率约 0.1 %~0.5%,其中儿童约为 2%~3%,此外,发达国家儿童患病率高达10%~20%。
当前,临床上针对特应性皮炎最主要的治疗药物为外用制剂,包括糖皮质激素和PDE4抑制剂等。阿布昔替尼片则是一款口服制剂,已于今年2月获FDA批准将特应性皮炎的适用人群扩展至青少年(12至<18岁)。
2.注射用盐酸头孢吡肟/注射用盐酸他尼硼巴坦组合包装
头孢吡肟是一种被广泛使用的β-内酰胺抗生素,他尼硼巴坦则是一种β-内酰胺酶抑制剂,二者的组合作为一种创新抗生素疗法,有望治疗难治性耐药革兰阴性菌引起的严重细菌感染及相关疾病。注射用盐酸头孢吡肟/注射用盐酸他尼硼巴坦由云顶新耀与Venatorx合作开发,其中云顶新耀拥有在大中华区、韩国和部分东南亚国家开发和商业化该组合疗法的权益。
据CDE官网显示,该产品的临床疗效优于现有治疗药物具有明确临床价值,因此被纳入拟优先审评,用于治疗18岁及以上患者由对本品敏感的细菌引起的复杂性尿路感染,包括肾孟肾炎。此外,FDA已于今年8月受理Venatorx 就注射用头孢吡肟/他尼硼巴坦提出的新药上市申请并授予其优先审评,预计将于2024年2 月22日前做出审评决定。
肾盂肾炎致病菌以革兰氏阴性杆菌中的大肠杆菌最为常见(60%~90%)。据云顶新耀报道,当前注射用盐酸头孢吡肟/注射用盐酸他尼硼巴坦正被开发用于治疗产超广谱β内酰胺酶(ESBL)肠杆菌目细菌、碳青霉烯耐药肠杆菌目细菌(CRE)和多重耐药铜绿假单胞菌(MDR-PA)等细菌引起的严重细菌感染。此外,据临床研究显示,该产品在微生物学意向治人群中,在TOC访视(第19-23天)的微生物学和临床复合成功率的主要疗效终点上优于美罗培南,且耐受性良好。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx