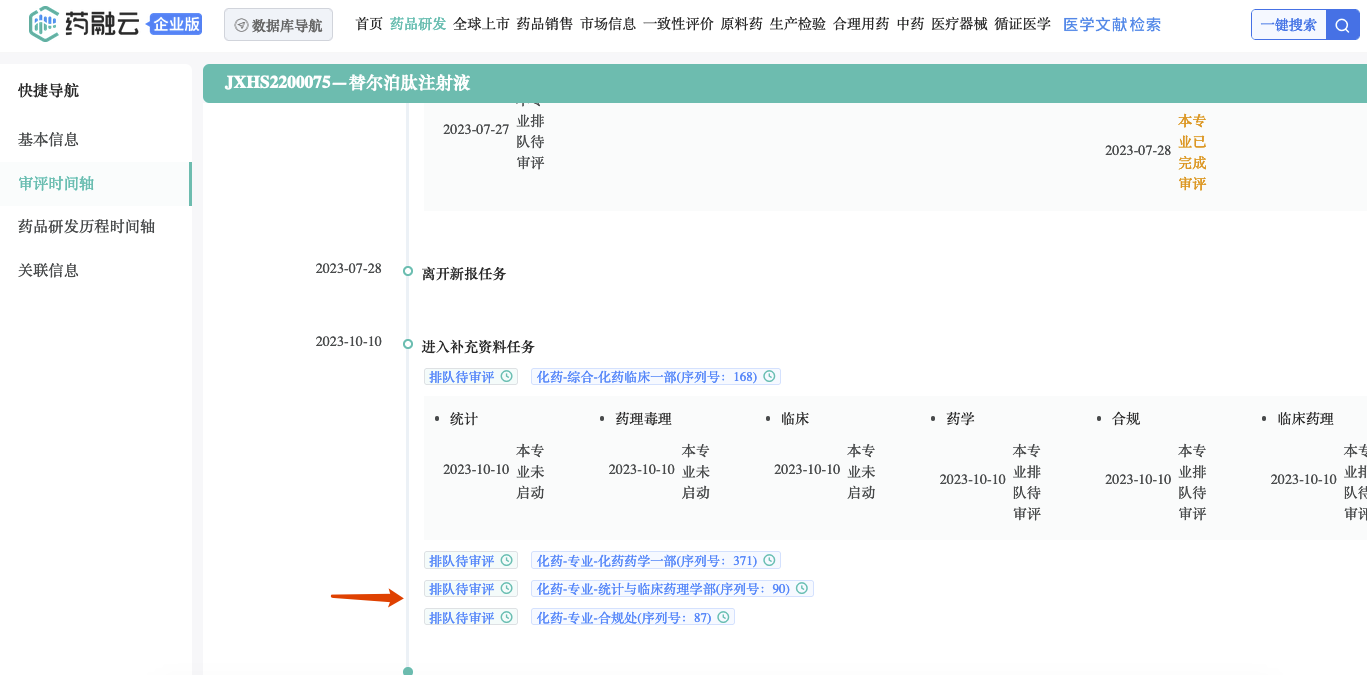
药融云数据www.pharnexcloud.com显示:2022 年 9 月7日,礼来制药/Eli Lilly and Company在中国递交的 Tirzepatide/替尔泊肽注射液2型糖尿病适应症的新药上市申请获NMPA/CDE 受理(受理号:JXHS2200075/6/7/8),当前正处于补充资料任务待审评中(2023年10月10日),预计将很快获批。中国商品名穆峰达。
2023年8月21日,礼来制药在中国递交了Tirzepatide/替尔泊肽注射液的新适应症上市申请,并获得受理。本次申请的适应症为:用于在低热量饮食和增加运动基础上改善成人肥胖或伴有至少一种体重相关合并症的超重患者长期体重管理。
每周一次注射的GIP/GLP-1受体激动剂Tirzepatide是一种单分子多肽,可结合并激活人体天然肠促胰素受体 GIP 受体和 GLP-1受体。GIP受体和GLP-1 受体均表达于大脑中调节食欲的重要区域。
Tirzepatide通过减少热量摄入和调节食欲来减少食物摄入、降低体重并降低脂肪含量;此外,Tirzepatide 已被证实可调节脂质利用。
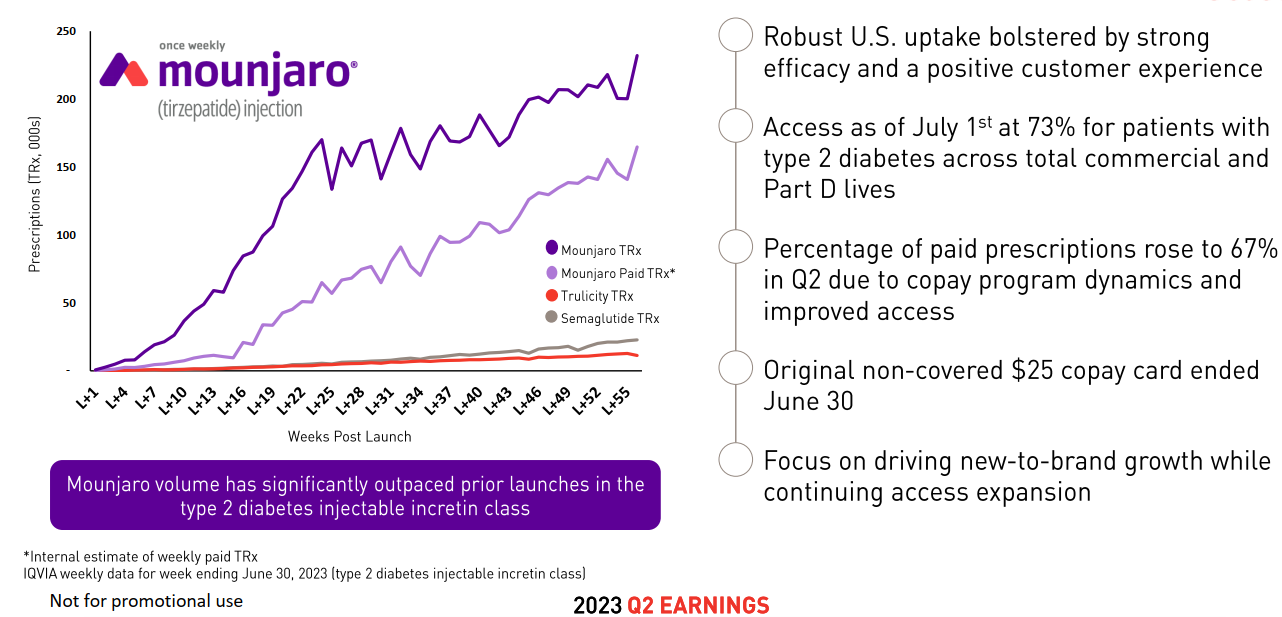
本品于2022年5月获美国FDA批准用于改善成人2型糖尿病患者的血糖控制(在饮食控制和运动基础上),商品名Mounjaro。
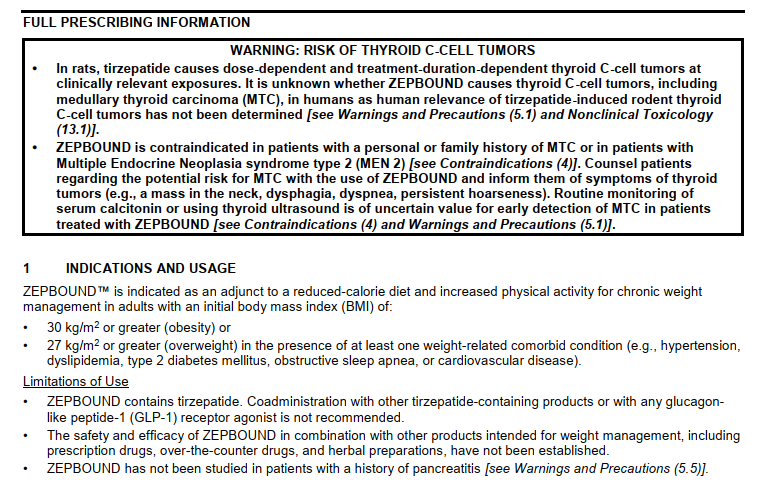
2023年11月,Tirzepatide获美国FDA批准用于BMI 30 及以上的肥胖症或者BMI 27 及以上且患有至少一种与体重相关的慢性病如高血压、2 型糖尿病或高胆固醇的超重人群的减肥治疗。商品名Zepbound。
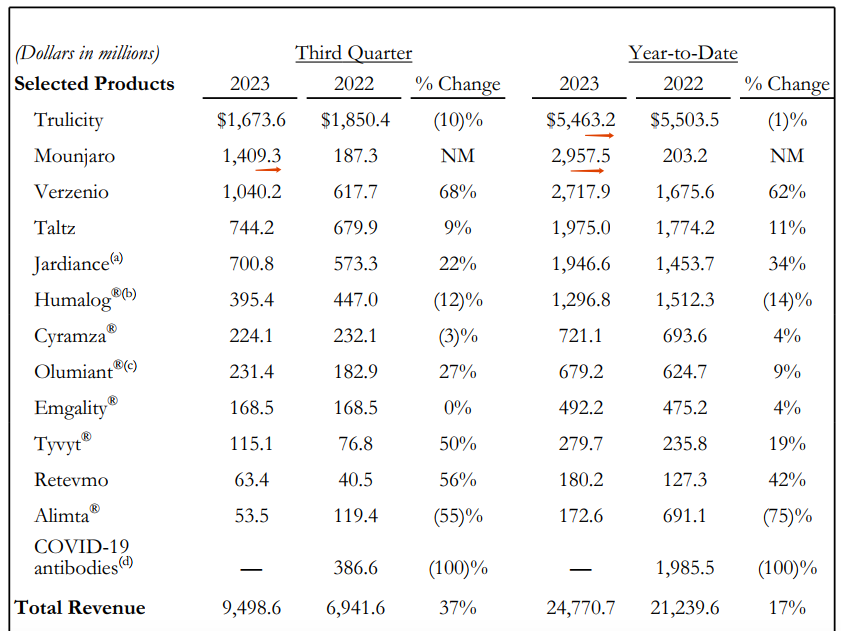
2023年前3季度礼来业绩,Tirzepatide/Mounjaro单季度业绩达14.09亿美元
一项SURPASS-AP-Combo研究结果于2023年5月25日在《Nature Medicine》上公布。结果表明,与甘精胰岛素相比,Tirzepatide在亚太地区(主要是中国)2型糖尿病患者人群中表现出更好的HbA1c和体重降低效果:治疗第40周的HbA1c降低最高达2.49%,体重降低最高达7.2kg(9.4%),对于血脂、血压均有明显的改善,并且总体安全性和耐受性良好。
SURPASS-AP-Combo 3期临床试验是Tirzepatide首次以中国2型糖尿病患者为主进行的研究,由北京大学人民医院纪立农教授牵头完成。SURPASS-AP-Combo与全球SURPASS系列研究结果一致,进一步证明了中国患者在糖尿病的病理生理上与全球患者是一致的,这是中国与全球同步研发新药的基础。
SURPASS-AP-Combo是一项为期 40 周的多中心、随机、开放标签的 Ⅲ 期临床试验,旨在比较接受三种不同剂量的 Tirzepatide(5 mg、10 mg、15 mg)和剂量滴定的甘精胰岛素治疗的有效性和安全性。
研究纳入了 917 名 HbA1c ≥ 7.5% 且 ≤ 11.0%,BMI ≥ 23 kg/m2 的成人 T2DM 患者,其中中国人群占 83.4%。研究结果表明,与甘精胰岛素相比,治疗第 40 周,Tirzepatide 组受试者的 HbA1c 较基线降低 2.24% 至 2.49%,显著优于甘精胰岛素组 0.95%(P < 0.001)。治疗第 40 周时,Tirzepatide 组 HbA1c < 7.0% 的患者比例最高达 86.0%,显著高于甘精胰岛素组 23.7%(P < 0.001);Tirzepatide 组患者的体重较基线降低 5.0 kg~7.2 kg,甘精胰岛素组体重增加 1.5 kg(P < 0.001)。研究中各组未报告严重低血糖事件,总体安全性和耐受性良好。
SURMOUNT-CN III期临床试验结果于2023年 10月 3日在 EASD以简短的口头讨论形式披露。
SURMOUNT-CN是一项多中心、随机、双盲、平行、安慰剂对照的III期临床试验,纳入肥胖(BMI≥28 kg/m2)或伴有至少一种合并症的超重(BMI≥24 kg/m2)的中国成人受试者,旨在低热量饮食和增加运动的基础上对比Tirzepatide 与安慰剂在体重减轻方面的有效性和安全性。研究入组了210名中国患者,以1:1:1的比例随机分组,分别接受Tirzepatide 10 mg或15 mg或安慰剂每周一次治疗。共同主要终点为在52周时Tirzepatide(10mg和/或15mg)相较于安慰剂在体重的变化百分比和达到体重减轻≥5%的患者比例方面的优效性。
基线时受试者平均体重为91.8kg、平均BMI为32.3kg/m2、平均腰围为104.8cm。研究结果显示,
第52周时 Tirzepatide 10mg组、15mg组平均体重自基线分别降低14.4%、19.9%,均优效于安慰剂组(降低2.4%)。
Tirzepatide 10mg组、15mg组达到体重减轻≥5%的受试者比例分别为91.4%、92.7%,优效于安慰剂组(29.4%)。
52周时Tirzepatide 10mg组、15mg组平均腰围自基线分别减少11.9 cm、16.4cm,优效于安慰剂(减少2.7cm)。
SURMOUNT-CN试验中Tirzepatide的总体安全性与先前试验报道相似,未发现新的安全性信号。Tirzepatide组最常报告的治疗期间不良事件为胃肠道不良事件,其严重程度大多为轻度至中度,主要发生在剂量递增期间。
参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露;
www.lilly.com;
FDA approves Lilly's Mounjaro™ (tirzepatide) injection, the first and only GIP and GLP-1 receptor agonist for the treatment of adults with type 2 diabetes. Retrieved May 13, 2022, from https://www.prnewswire.com/news-releases/fda-approves-lillys-mounjaro-tirzepatide-injection-the-first-and-only-gip-and-glp-1-receptor-agonist-for-the-treatment-of-adults-with-type-2-diabetes-301547339.html;
L Z. Efficacy and safety of tirzepatide once weekly in Chinese participants with obesity or with overweight and weight-related comorbidities. Abstract 542-SO . Presented at the EASD 59th Annual Meeting 2023; 2-6 Oct;
Tirzepatide注射液用于成人长期体重管理适应症在中国递交注册申请,https://mp.weixin.qq.com/s/HzcMNcPfoxObN1_HBkQ_cA;等等。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx