注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。
新药研发是一个具有高风险、高投入的漫长过程,FDA手握“生杀大权”其严苛的审核标准让很多产品被拒之门外,据不完全统计,仅10月份已有5款新药被FDA拒批,涉及到过敏性疾病、心脏疾病和眼科疾病,让我们一探究竟。
拒绝理由一:CMO问题
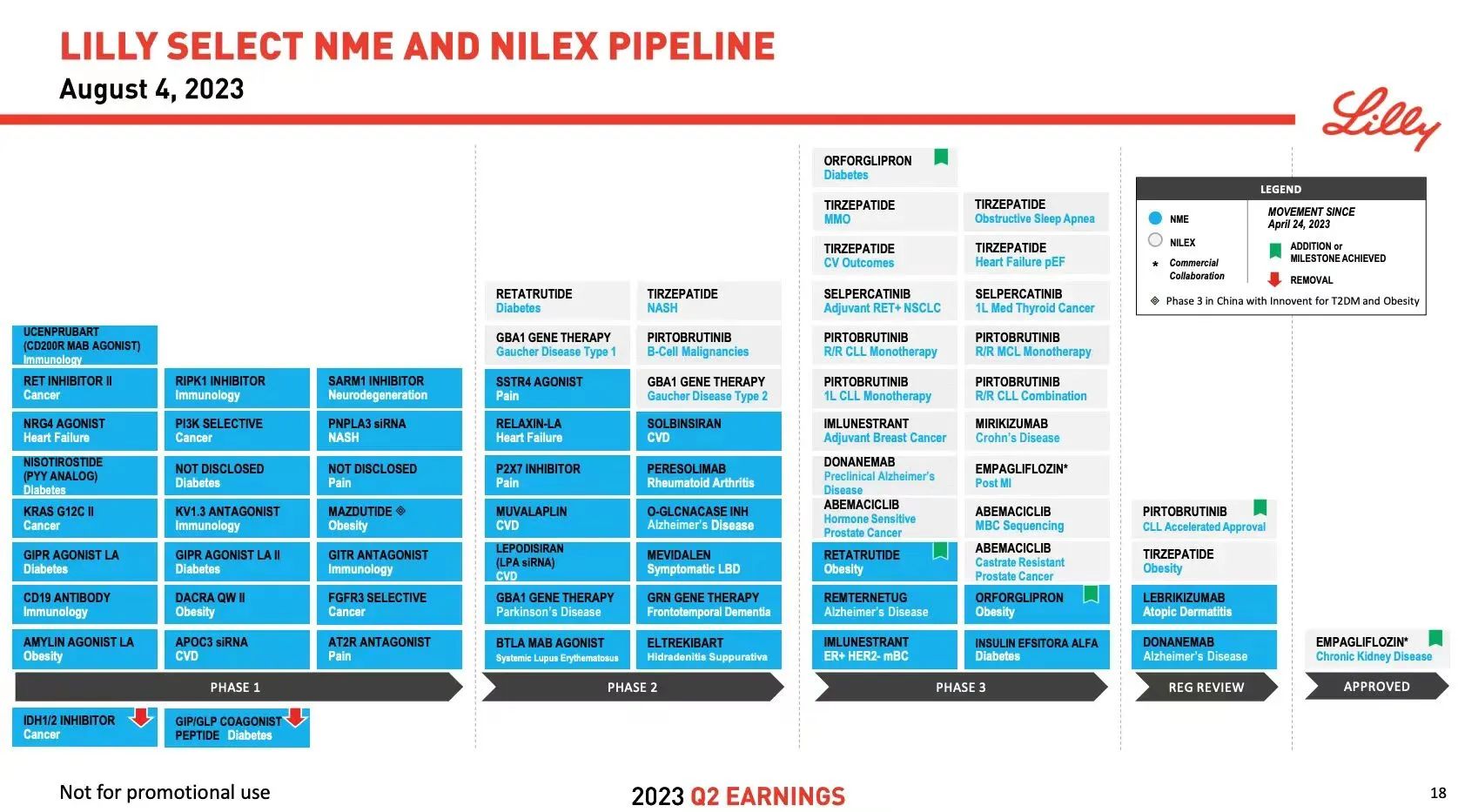
10月2日,美国FDA拒绝批准礼来lebrikizumab治疗中度至重度特应性皮炎(湿疹)的生物制剂许可申请(BLA),原因是在一家第三方制造商中发现了问题。来自美国监管机构的完整回应函(CRL)中没有提到对lebrikizumab的临床数据、安全性或标签的担忧,这增加了延迟不会太久的希望——假设CMO的问题可以解决或生产转移到新的合作伙伴。
礼来公司表示,CMO参与了单克隆抗体药物的生产,该公司表示,没有其他药物受到CRL的影响。该公司表示,将“继续与第三方制造商和FDA密切合作,以解决反馈意见,使患者能够获得lebrikizumab”。

公司研发管线
拒绝理由二:临床治疗效果不佳
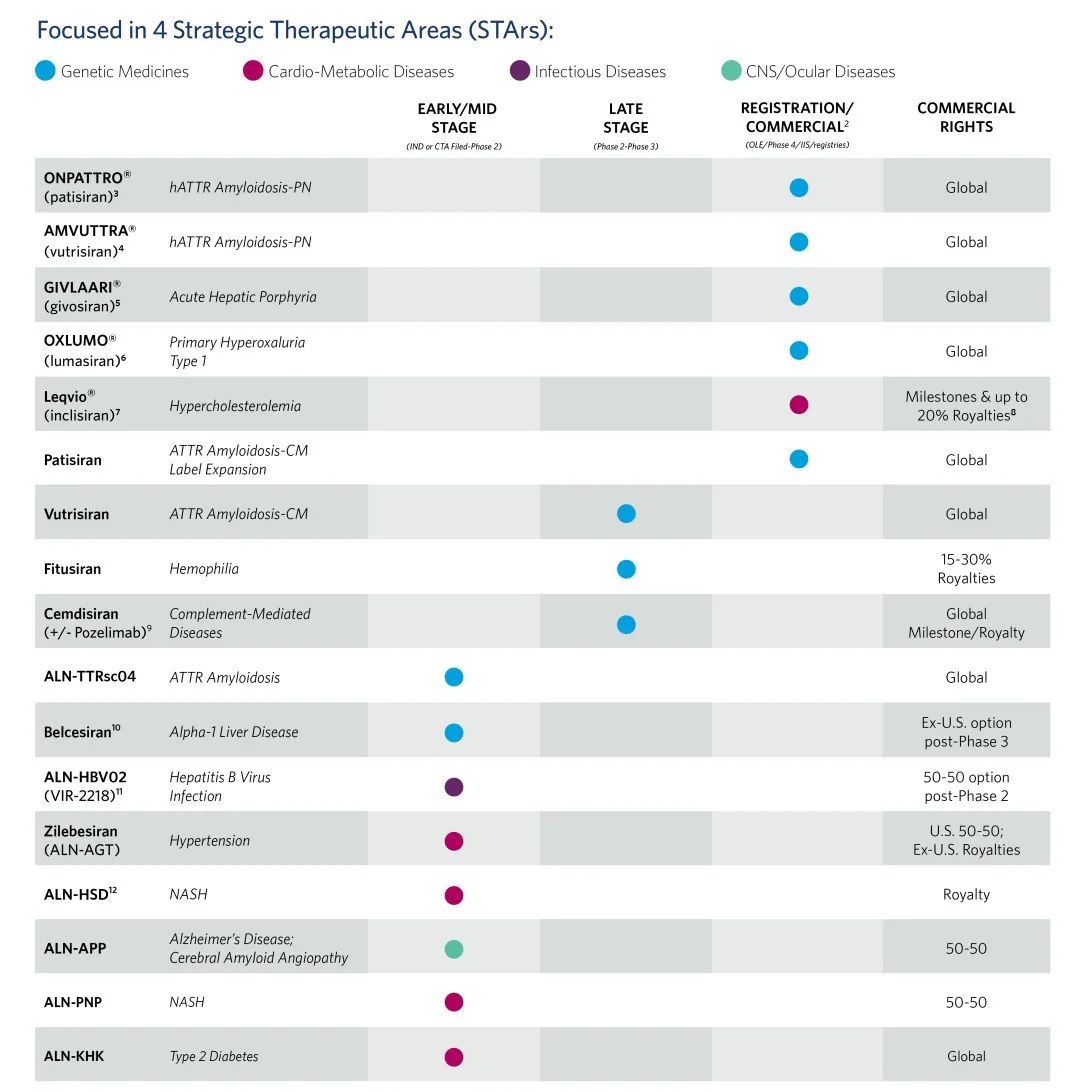
10月9日,Alnylam Pharmaceuticals宣布:美国FDA拒绝批准其RNAi疗法patisiran(商品名:onpattro)用于治疗转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)的上市申请。

早在今年9月13日,美国FDA心血管和肾脏药物咨询委员会(CRDAC)以9:3的投票认为,patisiran治疗ATTR淀粉样变心肌病的益处大于其风险。研究表明,与安慰剂相比,sNDA对ATTR淀粉样变性合并心肌病患者的功能能力、健康状态和生活质量产生了有利影响。
然而,此次FDA明确表示Patisiran对于ATTR-CM没有明显的临床治疗效果。
鉴于此结果,Alnylam将不再寻求扩大Patisiran在美国的适应症范围,而是将重点转向另一款治疗ATTR-CM的RNAi疗法——vutrisiran的III期研究。
公司研发管线
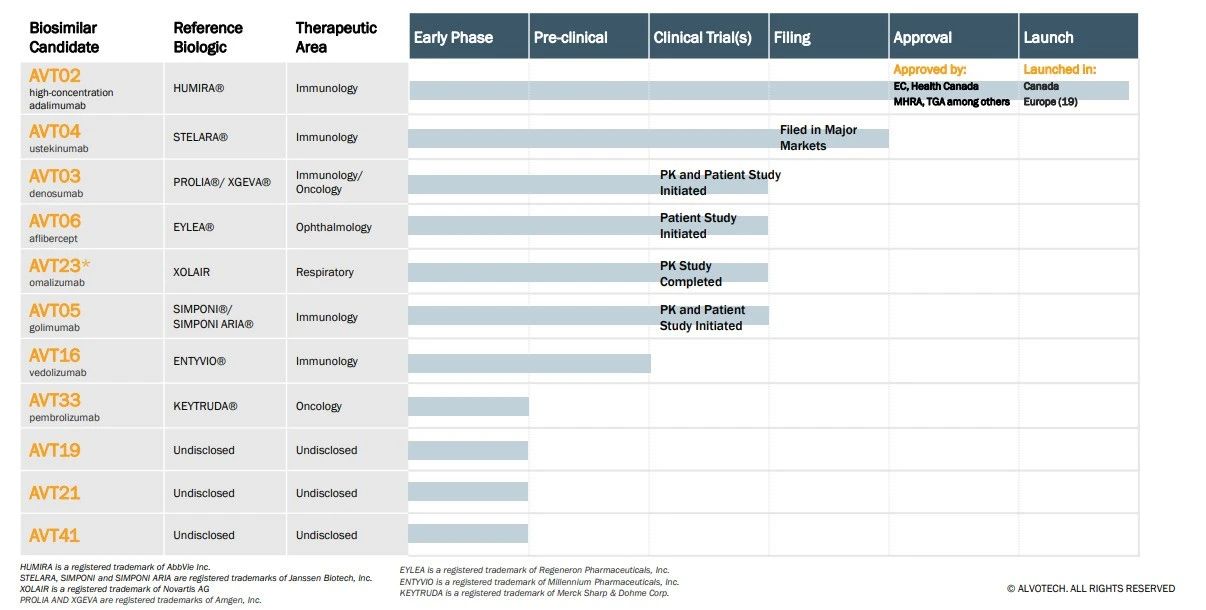
2023年10月12日,Alvotech公司宣布美国食品和药物管理局(FDA)拒绝批准其针对AVT04(乌司奴单抗)的生物制剂许可申请(BLA),该公司提议将AVT04作为强生公司Stelara(ustekinumab)的生物仿制药候选药物,这是该公司自去年以来第四次被监管机构拒绝批准。
监管机构在其完整回复函(CRL)中指出,Alvotech位于冰岛雷克雅未克的生产设施存在“缺陷”,FDA在2023年3月的现场检查中发现了这些缺陷。除此之外,FDA没有指出其AVT04的BLA中的任何其他问题,该公司打算近期重新提交BLA。这将触发另一个为期六个月的审查周期和新的生物仿制药用户费用修正案(BsUFA)目标行动日期。
Alvotech首席执行官Robert Wessman在一份声明中说:“根据我们与FDA的最新互动,我们目前预计该机构将在明年初重新检查我们的设施,使AVT04最迟于2025年2月提供给患者。”

公司研发管线
拒绝理由四:疗效数据不足
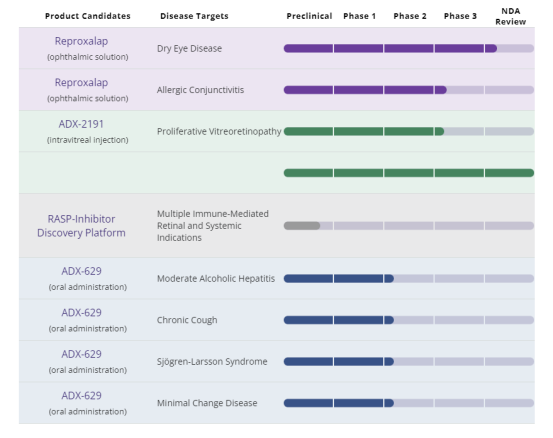
2023年10月16日,眼科药物开发商Aldeyra Therapeutics(纳斯达克股票代码:ALDX)在向美国证券交易委员会(SEC)提交的一份文件中披露,由于疗效数据不足,美国食品及药物管理局(FDA)可能不会批准其药物Reproxalap 用于治疗干眼症。
FDA就其申请批准该产品用于干眼病的会议记录显示FDA指出新药申请(NDA)有关的实质性审查问题:似乎没有数据支持眼部体征与干眼症适应症的临床相关性。Aldeyra补充说,该机构表示公司需要进行额外的临床试验,以满足疗效要求。
受此消息影响Aldeyra Therapeutics股价大跌66.3%。

公司研发管线
10月20日,再生元和赛诺菲宣布收到美国FDA就Dupixent(度普利尤单抗)治疗慢性自发性荨麻疹(CSU)的补充生物制剂许可申请(sBLA)发出的完整回复函(CRL)。CRL指出,需要额外的疗效数据来支持批准。再生元表示一项正在进行的临床试验(Study C)将继续招募患者,预计在2024年底获得结果,将提供额外的疗效数据。
赛诺菲公司和再生公司宣布,他们在3月份提交的批准申请基于两个被称为LIBERTY-CUPID 研究A和B的III期临床试验的数据。研究A评估了Dupixent与标准抗组胺药物一起用于6岁及以上未服用过奥马珠单抗的患者的疗效和安全性。研究B评估了Dupixent用于12至80岁、曾接受过标准治疗、对奥马珠单抗不耐受或未充分应答患者的疗效和安全性。赛诺菲的研究B在2022年公司报告Dupixent在中期分析中未能达到减少瘙痒和瘙痒的主要终点而停止。
正在进行的Study C是在与Study A相同的人群中评估度普利尤单抗的治疗效果。

公司研发管线

参考资料:各公司官网
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx