非小细胞肺癌(NSCLC)作为肿瘤免疫领域大适应症市场“兵家必争之地”,疾病早期临床治疗的市场大门正在被推开。
日前,媒体消息显示,默沙东(MSD)发布了旗下PD-1产品Keytruda(帕博利珠单抗、“K 药”)在早期NSCLC治疗的III期临床数据。

根据介绍,在该项III期临床试验中,手术前后使用帕博利珠单抗能够显著延长2到3b期的NSCLC患者的长期生存。默沙东方面回应媒体时表示,KEYNOTE-671试验的成功标志着免疫疗法首次显示出在早期NSCLC患者的具有统计学意义的总体生存(OS)获益。
有市场分析指出,美国食品药品监督管理局(FDA)已受理默沙东递交的新适应症上市申请(sBLA),并预计于2023年10月16日前公布审查结果;KEYNOTE-671临床试验取得阳性数据,或将刷新早期NSCLC的临床治疗路径。这项围手术期的重要临床进展,或许能够帮助K药拉长稳坐“药王”宝座的时间。
01早期市场助推K药持续增长?众所周知,肺癌是全球发病率和死亡率均居前列的致命癌种,2020 年 WHO 数据显示,全球有 220 万新发肺癌患者和 180 万例肺癌导致的死亡,而其中非小细胞肺癌占据了 81% 的比例。早期筛查无疑是延长肺癌患者生存时间的关键手段之一,对于早期肺癌患者的治疗,一直以来也都还存在空白。
此次默沙东官网公告的,正是旗下PD-1单抗 Keytruda 用于可切除的II期、IIIA 期或 IIIB 期NSCLC 围手术期治疗的III 期临床试验 KEYNOTE-671 研究达到主要终点 OS。与安慰剂+化疗新辅助治疗、术后安慰剂辅助治疗相比,Keytruda+化疗术前新辅助治疗、术后单药辅助治疗,在这些患者中显示出具有统计学意义和临床意义的 OS 改善,但具体数据将在稍晚一些的2023 ESMO大会上公布。

此前,FDA 已经接受默沙东递交的新适应症上市申请(sBLA),并将 PDUFA 决定日期设定在 2023 年 10 月 16 日。具体适应症为:K 药联用铂类化疗术前新辅助治疗 II 期、IIIA 或 IIIB 期 NSCLC 患者,随后在术后作为单药辅助治疗。
据了解,KEYNOTE-671 是一项随机、双盲全球多中心III期研究,首次启动于2017年11月(登记号:NCT03425643),共入组786例患者,1:1随机分配到K药组和安慰剂组。也是当前唯一采用无事件生存期(EFS)+总生存期(OS)双终点设计、探索围手术期免疫治疗疗效和安全性的Ⅲ期研究。
早在2023年上半年,默沙东就公布过KEYNOTE-671的中期分析数据,基于帕博利珠单抗围手术治疗方案与对照组相比,中位随访时间25.2个月,帕博利珠单抗联合化疗新辅助治疗并在术后行免疫单药辅助治疗,显著提高了患者的EFS,但中位EFS尚未达到(95%CI,345.1-NR)将可切除NSCLC患者的疾病复发、进展或死亡风险降低了42%,与单独接受化疗的患者17个月的EFS(95% CI,14.3-22)表现相比,有了明显的改善。
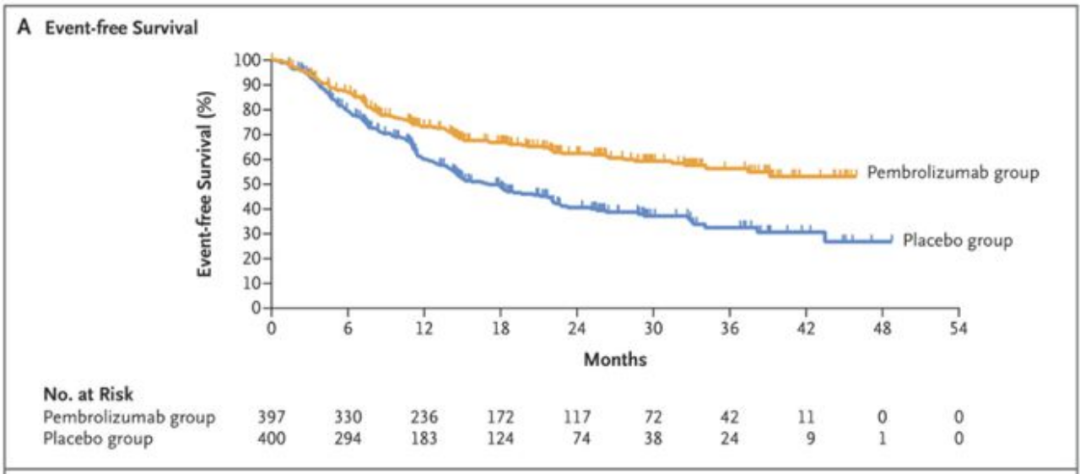
此外,KEYNOTE-671研究中,帕博利珠单抗联合化疗新辅助治疗组和化疗新辅助治疗组分别有98.5%和95.3%的患者接受了手术治疗,接受手术的患者中,两组的R0切除率分别为92%和84.2%(图2)12。
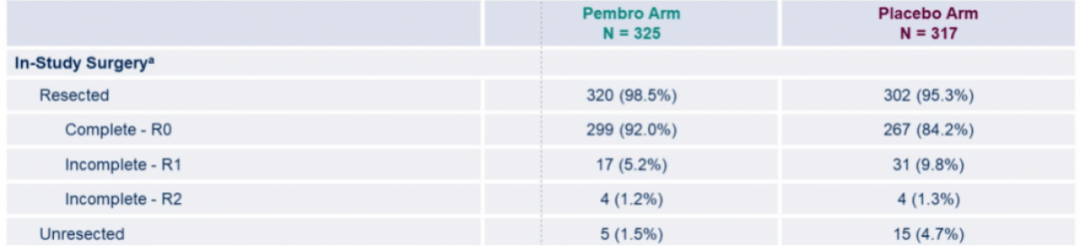
(图二)
据了解,KEYNOTE-671研究并未除外EGFR突变患者入组,在今年ASCO大会公布的数据(中位随访25.2个月)显示:包括33例EGFR突变NSCLC患者8(帕博利珠单抗组n=14,安慰剂组n=19)在内的所有预设亚组患者人群均能从帕博利珠单抗组治疗中获益,包括不同病理类型、疾病分期、PD-L1表达状态和EGFR/ALK突变状态的患者。在EGFR突变亚组中,EFS HR为0.09(95%CI 0.01-0.74)。
根据ClinicalTrials.gov上公开资料显示,帕博利珠单抗连同各种治疗方案已合计登记了超过400项试验。其中,在肺癌领域的适应症也已经有5项获批,涵盖了一线治疗、二线治疗和辅助治疗范围。若此次产品能够凭借KEYNOTE-671的试验成功,在sBLA获批,意味着帕博利珠单抗的适应症将推进到新的辅助环境中。
02辅助治疗价值赛道竞逐在PD-1全球化内卷的背景下,以肺癌为例,当前赛道玩家的目光已经不再局限于癌症后期这颗 “最顶上的果子”,而是逐渐向前期、围手术期等全面覆盖。随着如默沙东、百时美施贵宝、罗氏、阿斯利康这样的MNC玩家相继取得进展,本土企业也在抓紧推进PD-1的细分领域研发,这一赛道再次加速内卷。
事实上,除了PD-1赛道本身的内卷因素外,与晚期肺癌竞争“红海”不同,早期肺癌的市场竞争呈现出完全不同的景象,各类辅助治疗也是各大药企的攻克重心之一。
早在2021年的ACCR大会上,BMS的纳武利尤单抗的CheckMate-816研究以pCR率近11倍的获益惊艳亮相,为非小细胞肺癌(NSCLC)的新辅助免疫治疗里程碑揭开序幕。同年的美国临床肿瘤学会(ASCO)年会上,罗氏的PD-1产品阿特珠单抗也公布了其IMpower-010试验的中期结果。据了解,IMpower-010还是首个在早期肺癌辅助免疫治疗中获得阳性结果的III期临床研究。在自身取得成功的同时,也提示了辅助免疫治疗的巨大临床潜力。
2022年3月,中国国家药品监督管理局(NMPA)批准阿替利珠单抗单药用于检测评估为≥1%肿瘤细胞(TC)PD-L1染色阳性、经手术切除、以铂类为基础化疗之后的Ⅱ-ⅢA期非小细胞肺癌(NSCLC)患者的辅助治疗。这是目前中国获批的首个NSCLC 术后辅助免疫治疗适应证(基于IMpower010研究结果)。
2022年4月,BMS公布了III期临床研究CheckMate 816主要研究终点无事件生存期(EFS)的数据。结果显示,与单用化疗相比,可切除非小细胞肺癌(NSCLC)患者在术前接受3个疗程的纳武利尤单抗联合化疗,可显著改善患者EFS获益。
2022年6月,阿斯利康宣布 PD-L1 单抗度伐利尤单抗(Imfinzi)联合新辅助化疗用于可切除 NSCLC 术前新辅助治疗的 III 期临床试验 AEGEAN 研究结果积极。相较于单独新辅助化疗,联合疗法在中期分析中显著改善了病理完全缓解(pCR),具有统计学意义的改善,同时还观察到了主要病理反应(MPR)的统计学显著改善。
与此同时,“围手术期”这一新的辅助治疗理念也已经在国内外进行了多项III期研究,本土企业的相关研发进展也不甘落后。围手术期的辅助免疫治疗方式,创造性的在手术前和手术后都使用免疫治疗药物,将免疫药物贯穿于手术全程,以期将免疫治疗的作用发挥到极致,让患者能更好地从免疫治疗中获益。
有专家指出,同样是可手术切除的早中期NSCLC患者,相比I期和II期,III期患者的预后较差,异质性强,且具有手术难度大、术后创伤较大、复发率较高等特点,治疗难度极大。同时,III期患者约占全国新确诊非小细胞肺癌患者的1/3,患者基数很大,未满足的临床需求极大,亟需新药新策略来延长生存期。
2023年4月的ASCO年会上,君实旗下PD-1产品Neotorch研究首次中期分析结果公布:III期肺癌患者围手术期使用特瑞普利单抗+化疗,2年EFS率高达64.7%。相比于单独化疗,特瑞普利单抗的加入让III期肺癌患者复发、进展和死亡的风险降低了60%。此外,在另一个关键指标MPR率上,特瑞普利单抗+化疗组达到了48.5%,提升了近6倍(化疗组为8.4%)!病理完全缓解率(pCR率)28.2%,提高了28倍(化疗组为1.0%)。
另一本土巨头百济神州也在今年6月份发布消息称,Rationale-315研究报阳。根据介绍,这是一项由全国44家中心联合开展的替雷利珠单抗联合含铂双药化疗用于可切除NSCLC新辅助+辅助治疗的随机双盲III期临床研究,也是首个针对中国人群II/III期肺癌围术期免疫治疗成功的 III 期研究,也是成功验证免疫治疗针对肺癌围术期中国人群的最大规模III期研究。
随着早期肺癌“围手术期”辅助治疗的逐渐被攻克,相关患者的临床治疗选择也将越来越多样化了。从各大药企的临床试验方案也不难看出,无论是新辅助免疫治疗+手术、手术+辅助免疫治疗、亦或新辅助免疫治疗+手术+辅助免疫治疗,临床和市场都仍旧处于探索阶段。但可以预见地是随着PD-1在这一领域的“内卷”竞争提升,可以更大程度的推进相关的临床探索,在带来更广阔市场的同时,也能为患者提供更高临床价值的治疗方案。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx