阿斯利康AKT抑制剂Capivasertib在华申报上市
10月10日,CDE官网显示,阿斯利康AKT抑制剂Capivasertib上市申请获得受理。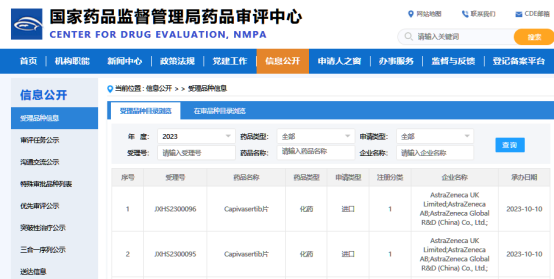
根据临床试验进展,推测适应症为联合Faslodex(氟维司群)治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者,这些患者在接受内分泌基础方案治疗过程中或之后疾病复发或进展。
Capivasertib是一款潜在first-in-class的AKT1/2/3高效选择性抑制剂。AKT信号通路的激活,包括PIK3CA、AKT1和PTEN的改变,可出现在许多HR+/HER2-的晚期乳腺癌患者中,但也可能出现在没有这些基因改变的患者中。AKT信号通路与内分泌治疗耐药的发生有关。
本次上市申请基于一项代号为CAPItello-291的III期研究的积极数据。该研究是一项全球、多中心、双盲、随机的III期临床试验,共纳入708例患者,旨在评估capivasertib+氟维司群对比安慰剂+氟维司群治疗HR+/HER2-晚期乳腺癌患者的疗效和安全性,这些患者在接受AI治疗期间或之后疾病复发或进展。
2023年6月,阿斯利康宣布FDA已受理capivasertib联合Faslodex(氟维司群)的新药申请(NDA)同时被授予了优先审评资格,用于治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者,这些患者在接受内分泌基础方案治疗过程中或之后疾病复发或进展。
罗氏GPRC5D × CD3双抗在中国获批临床
近日,CDE官网公示,罗氏(Roche)申报的forimtamig获得临床试验默示许可,拟开发治疗多发性骨髓瘤。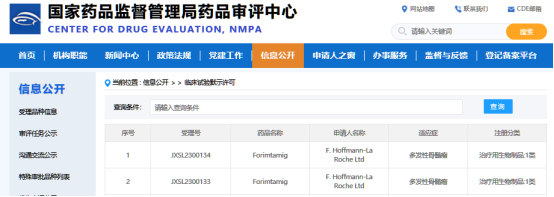
公开资料显示,forimtamig(RG6234)是一款可同时靶向GPRC5D和CD3的双特异性抗体,正在海外开展治疗多发性骨髓瘤的1期临床试验。
GPRC5D是G蛋白偶联受体家族C组5成员D,在多发性骨髓瘤细胞中特异性高表达,并且与不良预后因子相关,不过它几乎不在正常组织上表达。目前,靶向BCMA的免疫疗法是多发性骨髓瘤患者的治疗选择之一。但对于BCMA阴性或BCMA低表达的患者,以及BCMA靶向治疗后因靶细胞抗原免疫逃逸而出现的BCMA阴性复发类患者,GPRC5D靶向疗法有望带来新的临床获益。
此前,forimtamig已在针对重度预处理的复发/难治性多发性骨髓瘤患者的1期临床试验中,取得良好的疗效和可控的安全性。
百奥泰/渤健开发托珠单抗生物类似药TOFIDENCE,获FDA批准上市
10月8日,百奥泰宣布,其合作伙伴近期收到FDA通知,TOFIDENCE(BAT1806/BIIB800)(一款由百奥泰参照雅美罗®(托珠单抗)开发的生物类似药)静脉注射液获美国FDA上市批准,用于治疗中到重度类风湿性关节炎、多关节型幼年特发性关节炎、全身型幼年特发性关节炎。
TOFIDENCE是一款靶向白介素-6受体(IL-6R)的重组人源化单克隆抗体,可与可溶性及膜结合型IL-6受体(sIL-6R和mIL-6R)特异性结合,并抑制由sIL-6R和mIL-6R介导的信号传导,用于治疗中到重度类风湿性关节炎、多关节型幼年特发性关节炎、全身型幼年特发性关节炎。
2021年4月,百奥泰与渤健就TOFIDENCE(BAT1806/ BIIB800)签署合作协议,由百奥泰研发的TOFIDENCE将由渤健对其进行除在中国(包括香港、澳门和台湾)以外所有国家的商业化。
赛诺菲庞贝病新药在华获批上市
10月7日,赛诺菲宣布其注射用艾夫糖苷酶α(商品名:耐而赞)获国家药监局批准上市,用于庞贝病(酸性α葡萄糖苷酶[GAA]缺乏症)患者的长期酶替代治疗。
庞贝病是一种罕见的进行性神经肌肉疾病,由酸性α葡萄糖苷酶(GAA)的遗传缺陷或功能障碍和溶酶体糖原积累引起,会导致骨骼肌和心肌细胞中糖原的积累,进而出现肌肉无力,甚至因呼吸衰竭或心力衰竭引起过早死亡。
艾夫糖苷酶α是一种高效酶替代疗法,可以靶向6-磷酸甘露糖(M6P)受体,从而改善GAA向肌肉细胞的递送,使得多余的糖原得以分解,减少对患者肌肉细胞的损伤。2021年8月,该产品获FDA批准上市,用于治疗1岁及以上患者治疗晚发型庞贝氏症;2022年6月在欧洲获批上市。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx