
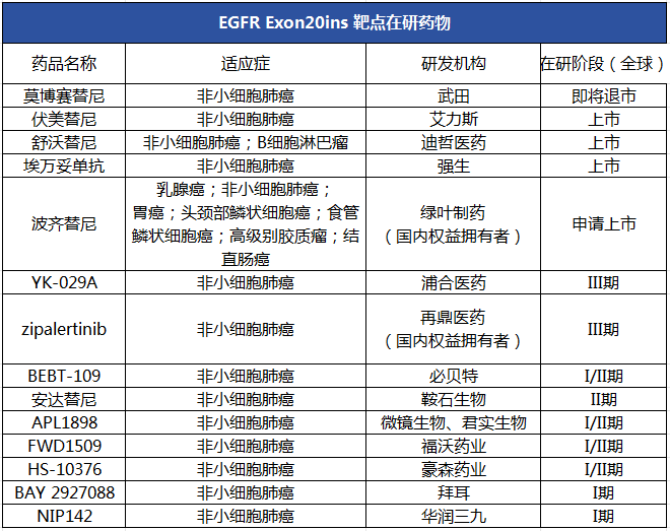
肺癌是常见的恶性肿瘤之一,非小细胞肺癌(NSCLC)是肺癌最常见的组织学分型,约占肺癌的85%。表皮生长因子受体(EGFR)突变是NSCLC最常见的驱动基因,EGFR外显子20插入(EGFR exon20ins)突变作为EGFR罕见突变中最常见的亚型,约占EGFR突变型NSCLC的4%—12%。
目前,全球已有四款针对EGFR exon20ins NSCLC药物获批上市,分别是武田的莫博替尼、强生的埃万妥单抗、艾力斯的伏美替尼以及迪哲医药的舒沃替尼。此外,在EGFR exon20ins NSCLC领域仍有众多小分子药物处于临床开发阶段。一批国产创新药企业亦在这一赛道你追我赶,浦合医药、鞍石生物、必贝特等临床进展居前。
一线败北
退市早有端倪
2021年9月15日,FDA以加速批准路径,批准莫博赛替尼用于EGFR外显子20插入突变阳性的前序含铂化疗治疗失败的晚期非小细胞肺癌成人患者,并以一线治疗的EXCLAIM-2 III期临床试验作为确证性试验,以此结果确认长期获益,并将加速批准转为完全批准。
此次武田主动启动莫博赛替尼退市正是基于3期EXCLAIM-2试验结果,该试验不符合其主要终点,因此不符合美国FDA加速批准的相关确认要求,也不符合其他国家批准的有条件上市批准的要求。
EXCLAIM-2试验是一项3期、多中心、开放性研究,旨在调查莫博赛替尼作为单一疗法与基于铂类的化疗在一线EGFR exon20 ins突变局部晚期或转移性非小细胞肺癌中的安全性和有效性。
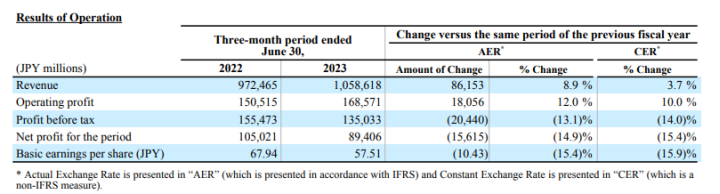
2023年7月,武田发布了2023年Q1季度(4-6月)业报,其中显示已获批表皮生长因子受体(EGFR)Exon20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)二线治疗资格的EGFR exon 20抑制剂莫博赛替尼在EXCLAIM-2研究中因无效而终止。公司正在与监管机构就这些数据进行讨论,并将决定下一步的行动。

当时业界有一个疑问,武田是否撤回莫博赛替尼加速的二线适应症。10月2日的新闻稿确认了这个疑问,即武田将主动撤回莫博替尼在美国获批的适应症。这意味着莫博替尼将在不久撤出美国市场。
武田2023年第一季度总收入为1.059万亿日元(约为75亿美元),同比增长8.9%。根据财报,武田预计莫博赛替尼的最高销售额将达到3亿至6亿美元。在截至今年3月的12个月里,这款EGFR抑制剂的销售额为2600万美元。武田曾表示,莫博赛替尼和强生的埃万妥单抗平分了二线市场。值得一提的是,强生此前已宣布其埃万妥单抗已经成功地延缓了一线NSCLC患者的癌症进展。
武田计划在莫博赛替尼获得批准的全球范围内发起类似的自愿撤回,并正在与目前可使用该药物的其他国家的监管机构合作开展后续步骤。在业内看来,因为在EXKIVITY 1/2的二线单臂试验成功后,武田直接让莫博赛替尼在Exclaim-2里作为一线单药疗法与化疗硬碰硬,这个操作略显激进。对武田来说,退市打击最大的还是全球市场。作为潜在的增长动力,莫博赛替尼在美国撤市会对公司未来的增长计划产生巨大影响。
02
一线争霸
谁将抢占先机?
在莫博赛替尼退市后,全球范围内仅埃万妥单抗和迪哲医药的舒沃替尼两款药物适用于铂类化疗失败后的EGFR exon20ins NSCLC治疗。其中,舒沃替尼是国内首款EGFR exon20ins靶向药物上市。
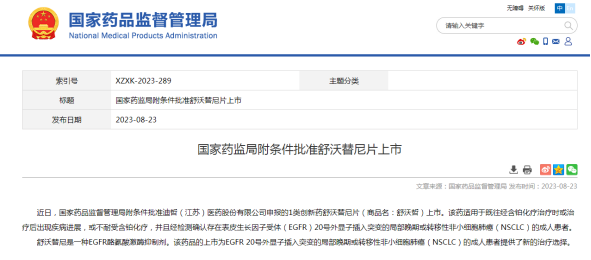
舒沃替尼获批主要基于舒沃替尼在中国注册的WU-KONG6临床试验结果,该研究是一项针对含铂化疗进展或不耐受的EGFR exon20ins晚期NSCLC患者的单臂、多中心2期临床研究。结果显示,在接受舒沃替尼治疗的97例疗效分析人群中,对于经治患者,经IRC确认的ORR达60.8%,疾病控制率(DCR)达87.6%,安全性与传统EGFR-TKI相似,整体耐受性好,绝大多数不良反应都是1-2级,临床管理可控。
舒沃替尼是目前唯一一款将经治的EGFR exon20ins突变患者ORR提升至50%以上的新药,打破EGFR exon20ins的治疗困局。
不过目前已经上市的3款针对EGFR exon20ins的靶向药物均获批在二线,而一线标准治疗方案仍是含铂化疗,临床治疗的有效性方面仍有提升空间。同时,强生的埃万妥单抗静脉输注或是患者依从性的重要影响因素,而莫博赛替尼的一线临床研究失败,也是呼唤新的口服药物来填补临床需求。
一般而言,小分子药物的口服便利性和成本优势,在患者顺应性和临床可及方面存在先天优势。目前,在EGFR exon20ins NSCLC领域仍有众多小分子药物处于临床开发阶段,包括三代EGFR抑制剂伏美替尼在突变一线治疗中显示了不错的临床效果。

2023年4月艾力斯宣布获得CDE批准,伏美替尼EGFR exon20ins NSCLC一线治疗适应证获得药物临床试验批准。这是伏美替尼在中国获批的首个国际多中心临床试验,也是艾力斯ArriVent合作的第一个全球、III期、多中心、随机、开放标签研究(FURMO-004研究)。除此次中国获批外,FURMO-004研究已在美国、法国、日本等多个国家获批进入临床,目前正处于患者入组阶段。
2023世界肺癌大会(WCLC)公布了伏美替尼一线治疗EGFR exon20ins突变晚期NSCLC的IB期研究(FAVOUR研究)结果。该研究共纳入90例未经治疗的EGFR 20ins患者,一线使用伏美替尼(240 mg)治疗,ORR达到了78.6%,中位持续缓解时间(DoR)达到了15.2个月。预计中位无进展生存期(PFS)将超过10个月,远高于标准含铂两药化疗方案。安全性方面,伏美替尼的耐受性良好,在爬坡阶段剂量从20mg上升至240mg也并未出现剂量限制性毒性(DLT)和最大耐受剂量(MTD)。
除伏美替尼外,其他临床在研的EGFR exon20ins小分子抑制剂也有着不俗的初步表现。2023年ASCO会议期间,YK-029A公布了一项纳入108例患者的I期临床研究数据。结果显示,在28例未接受过治疗的患者中,YK-029A经IRC确认的ORR达到了73.1%,mPFS为9.3个月,OS约为11个月。
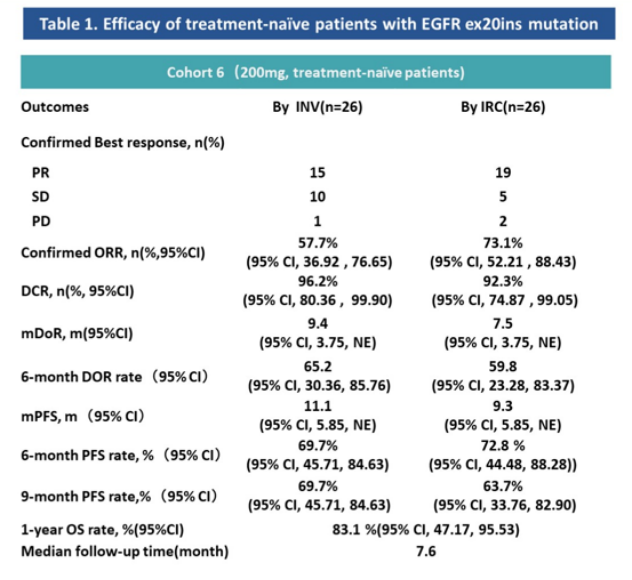
YK-029A是浦合医药开发的一款针对EGFR exon20ins的小分子抑制剂,虽然初步展现了不俗的临床潜力,但仍需要在验证性临床研究中进一步确认。
中国创新药企一直是EGFR领域的重要玩家,一批国产创新药企业亦在这一赛道你追我赶。在风云骤变EGFR exon20ins NSCLC领域,随着武田的莫博赛替尼折戟,走完验证性临床的埃万妥单抗能否稳坐“一方霸主”之位、抑或小分子药物可否再度逆势翻盘,布局者前途几何?仍有待时间考证。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx