整个现代制药产业体系,都建立在知识产权壁垒之上。
近年来,中国医药行业快速升级,产业高水平创新和市场国际化的步伐逐渐加快,无论是国内企业的创新药、仿制药“出海”,还是Me-too新药、首仿药布局研发,作为后进者的中国企业必须设法绕过先行者们设置的壁垒。
前不久,国家知识产权局发布了针对申请号为“201380063930.5”,发明名称为“PCSK9 iRNA组合物及其使用方法”专利的无效宣告请求审查决定书(第561449号),维持了专利权全部有效。无效宣告请求人李彩辉为君实生物控股子公司君拓生物的知识产权负责人。
据悉,此次专利交锋针对的是近年来心血管领域的重磅品种Inclisiran,即诺华拥有的全球首创小干扰RNA降胆固醇药物英克司兰钠注射液(商品名:乐可为®)。本次审查决定书的宣告,意味着君实生物此次专利挑战未能取得理想中的成果。

围绕此次专利案件的相关情况,《医药经济报》新媒体中心记者曾向君实生物邮件询问相关事项的进展和细节情况,但截至发稿,君实生物并未对此事件给予回复。
事实上,专利挑战仅仅只是中外企业医药研发技术较量的开端。尤其是在过去的一年中,无论是聚焦创新药的君实生物、百济神州,还是深耕高技术仿制药的石药集团、华东医药、东阳光,医药市场如何最大限度保护创新同时推动药品可及性,进一步维护公平竞争、促进科技进步和社会公众需求,药品专利纠纷正在吸引越来越多的产业目光。
聚焦降脂药物潜力市场
新技术须面对专利考验
君实生物此次专利无效宣告申请,涉及靶向PCSK9基因的RNAi剂例如双链RNAi剂,和使用这类RNAi剂来抑制PCSK9表达的方法以及治疗患有脂质失调例如高脂血症的受试者的方法。其中包含的两个关键词“PCSK9”和“RNAi”,无疑是本次专利较量的核心关注点。
作为PCSK9赛道重要的市场参与者,君实生物已经在今年4月份提交了公司自主研发的昂戈瑞西单抗(JS002)的新药上市申请,这款重组人源化抗PCSK9单克隆抗体,是君实生物慢性代谢管线中首款进入商业化申报阶段的产品。正因如此,进一步延伸PCSK9靶点产品布局,尤其聚焦新一代PCSK9产品研发,成为摆在君实生物面前的必然选择。
本次专利纠纷案件的核心,正是PCSK9赛道上划时代的新产品——英克司兰钠注射液。从专利内容来看,PCSK9靶向RNAi药物英克司兰钠注射液(Inclisiran)所拥有的关键核心专利,权利要求保护内容涉及英克司兰的序列、组合物、治疗高胆固醇血症的医药用途等,专利到期日为2033年12月5日。
业内人士分析认为,对于专利权人而言,其专利如果受到无效挑战,往往意味着该专利对同赛道内的其他玩家造成了市场阻碍;君实生物的Fast-follow研发经验极为丰富,RNA药物作为前沿技术领域,君实生物正在逐渐加大研究与布局。
2023年1月,君实生物1类新药JS401注射液首次申报临床。君实生物在2022年年报中提到,JS401是公司与润佳(上海)医药技术有限公司共同研发的一种靶向血管生成素样蛋白3(ANGPTL3)信使RNA(mRNA)的小干扰RNA(siRNA)药物,拟主要用于高脂血症等治疗。
虽然ANGPTL3与PCSK9靶点不同,但是,手握PCSK9靶点药物昂戈瑞西单抗以及RNA药物研发平台的君实生物,显然看到了更大的市场空间。今年8月,诺华中国宣布英克司兰钠注射液获批上市,作为饮食的辅助疗法,用于成人原发性高胆固醇血症(杂合子型家族性和非家族性)或混合型血脂异常患者的治疗。
作为全球首个用于降脂的小分子干扰RNA(siRNA)药物,英克司兰钠注射液最初于2020年12月在欧盟获批,用于治疗成人高胆固醇血症或混合性血脂异常;2021年12月获得FDA的上市批准,并于今年7月获FDA批准,将适应症扩大为原发性高脂血症成人患者。
凭借“一年两针”的治疗优势,英克司兰钠注射液2023年上半年其销售额达1.42亿美元,已超越2022年全年市场规模。显然,英克司兰钠注射液这款被行业预期年销售额将突破30亿美元的“超级重磅”,已经被君实生物盯上。
专家分析指出,通过专利检索可以发现,开始锚定RNA药物赛道的君实生物,正在试图推开PCSK9 iRNA药物的大门,本次对诺华发起“专利挑战”,正是在为其后续产品管线的研发提前布局,这也意味着君实生物能否绕开诺华的专利保护至关重要。

PCSK9赛道拥挤
产品迭代迫在眉睫
从目前的市场结果来看,诺华相中英克司兰钠注射液的确也是慧眼识珠。
2013年,阿里拉姆制药与The Medicines签订许可和合作协议,后者获得Inclisiran的全球独家许可。2015年后,The Medicines承担了该药全部后续开发和商业化的责任。2019年,诺华耗资97亿美金收购The Medicines,顺理成章将这款被心血管领域专家誉为“心血管疫苗”的RNAi疗法Inclisiran收入囊中。
根据诺华财报,Inclisiran在商业化的第一年就实现了1200万美元销售额;2022年进一步放量,销售额增长833.3%,达到1.12亿美元。从放量速度来看,如今相继适应症范围扩大、中国获批上市,后续其市场表现非常值得期待。
目前,我国共上市3款进口PCSK9抑制剂,分别是安进/安斯泰来的依洛尤单抗(Evolocumab,瑞百安)、再生元/赛诺菲的阿利西尤单抗(Alirocumab,波立达),以及刚刚获批的英克司兰钠注射液。
三种药物都是注射剂型,其中,依洛尤单抗和阿利西尤单抗半衰期短,需每月注射1~2次;英克司兰超长效,第一次用药后第90天注射一次,之后只需每6个月注射一次。因而,诺华的英克司兰钠注射液一上市就获得心血管医生及患者的青睐。
巨大市场空间引发了激烈的市场竞争。目前,已有不少本土药企投入这款新药的研发行列中,信达生物的托莱西单抗是中国首个获批的本土自主研发PCSK9抑制剂;除此以外,君实生物、康方生物、恒瑞医药、信立泰、天士力生物、复宏汉霖等国产PCSK9单抗亦处于申报上市的阶段,有望于近期获批。后续PCSK9抑制剂药物的竞争必然越来越激烈。
事实上,作为降脂药物的热门靶点,PCSK9的知识产权较量不仅“寸土寸金”,而且旷日持久,仅赛诺菲和安进围绕PCSK9的专利“战火”,就从美国市场到欧洲市场,一路蔓延到亚洲市场,甚至在2020年5月,赛诺菲的Praluent(alirocumab,阿利西尤单抗注射液)由于在与安进的PCSK9抑制剂的专利诉讼中败诉,宣布退出日本市场(点击了解详情)。彼时,围绕“表位保护”“优先权日”“实施例数量”“客体例外”等专利法律博弈,也为抗体专利提供了一个绝佳的研究案例。

市场观点普遍认为,随着国内药企的创新能力不断增强,细分领域竞品公司之间,尤其是后来者对先行者掀起的专利挑战,势必会成为未来医药行业的常态。
“现在的药物创新方向,创新药物专利申请围绕表位基因序列的专利申请已经得到越来越多的重视。专利申请应当仔细权衡现有技术、可预测水平和现有数据,将数据尽可能多地放到专利说明书中,从权利要求项开始尽可能把自己想要保护的关键产品,甚至将Bio-too、Biosimilar药物尽可能保护进去,同时重点关注与结构表征相关的权利要求。另外,规避设计的选项、从属权利要求项、功能限定抗体结构保护、商业秘密等都需要审慎考虑。”
专利争夺“硝烟四起”
国内企业全面参战
“产品未动,专利先行”,药企之间专利之争背后是商业利益的博弈,利用专利等知识产权赢得市场竞争中的先机,已经成为全球医药市场竞争中至关重要的一环。
近年来,中外药企围绕创新药专利的争端事件时有发生。
近期最受关注的无疑是百济神州的泽布替尼(商品名:百悦泽)。就在前不久,艾伯维旗下的Pharmacyclics指控百悦泽侵犯了伊布替尼的专利,并已在美国特拉华州地方法院提起诉讼,请求法院判决认定百济神州及BeiGene USA,Inc.(百济神州全资子公司)就百悦泽开展的相关活动导致及将导致他人侵犯其专利,以及给予其法院认为适当的赔偿等。

百济神州随即发布公告,并公开表示针对泽布替尼已经建立具有原创性和创新性的全球知识产权体系,公司高度重视和尊重有效且可执行的知识产权,对泽布替尼的知识产权抱有充分信心。
在仿制药领域,伴随药审改革以及一致性评价工作的深入推进,新版《专利法》对“专利链接”相关政策落地,市场竞争格局的变化,专利较量胜负难料,原研药与国内头部制药企业之间的知识产权较量可谓汹涌澎湃,这一情况促使跨国企业的市场竞争策略必须面对更大考验。
“明星产品”司美格鲁肽的爆火也吸引了国内众多仿制药企业入局,由于诺和诺德的司美格鲁肽核心专利将于2026年到期,因此也吸引了众多实力企业抢先跟进。
2021年6月10日,华东医药递交了司美格鲁肽的专利无效申请,2022年9月5日国家知识产权局判定司美格鲁肽核心专利CN200680006674.6全部无效。这也意味着,国产司美格鲁肽有望在2026年之前进入市场。不过,诺和诺德已经就国家知识产权局的这一决定上诉至北京知识产权法院,后续将进入知识产权诉讼阶段。
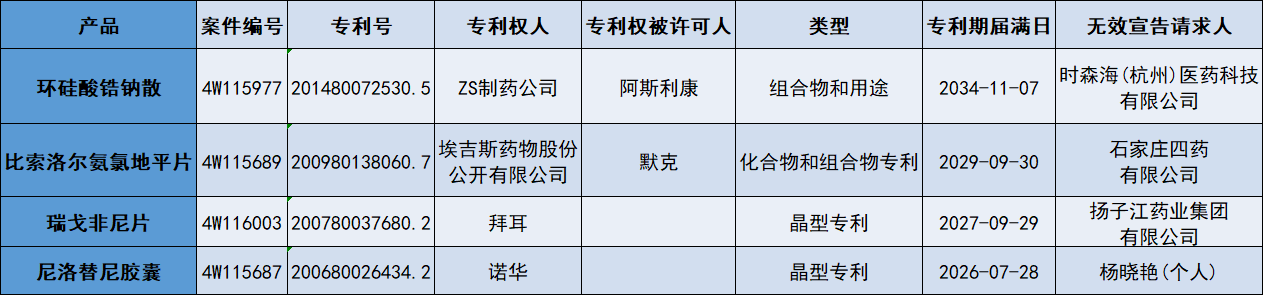
除此之外,近期还有数款原研药品的相关专利在国内遭遇专利无效挑战,涉及化合物、组合物、用途、晶型等,如阿斯利康的环硅酸锆钠散、默克雪兰诺开发的比索洛尔氨氯地平片、拜耳的瑞戈非尼片、诺华开发的尼洛替尼,时森海(杭州)医药、石家庄四药、扬子江药业等企业分别向跨国药企发起冲击。
在海外市场,中国药品想要加速“出海”进程,同样需要跨过专利考验。芬戈莫德是东阳光较早布局的产品,也是国内较早布局的药企之一,该项目2011年7月立项,分别在中国、美国和欧盟申报,其中欧洲(西班牙、德国和意大利)和美国已经获批。去年10月,东阳光宣布,10月18日美国法院正式宣判’405专利无效,广东东阳光药业有限公司首仿的芬戈莫德胶囊正式被获批允许在美国上市销售。

业内专家指出,药品专利效力之争,关乎药品的创新研发,关乎老百姓能否“吃好药”“吃便宜药”。一方面,专利保护是创新药产品能否独占市场的核心因素,原研药为了延长产品生命周期,会为产品设计复杂的专利保护策略;另一方面,对于仿制药而言,若想提前上市,第一步就是要破解或规避原研药的专利的保护,而主动无效原研药专利无疑是最便捷的方案。
无论是创新药企还是仿制药企,医药市场全球化、一体化的潮流势不可挡,中国企业在逐步提升医药研发创新技术水平、全面参与全球市场竞争的同时,也更有信心在知识产权的较量中站上擂台。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx