今年以来,创新药正在进入申报和上市的“井喷期”。
据米内网中国申报进度(MED)数据库统计,截至9月28日,创新药(药品注册分类为1的品种)注册申请超过2000件,其中临床试验申请和补充申请仍然居多;创新药上市许可申请(NDA)为99件,涉及56家药企申报的超过60个品种。
值得注意的是,根据《2022年度药品审评报告》,从近五年创新药NDA受理量可以看到,今年以来的受理量出现大幅增长,已创下新峰值。这意味着,厚积薄发的创新药领域正在迈向新增长曲线,迎来报产大年。
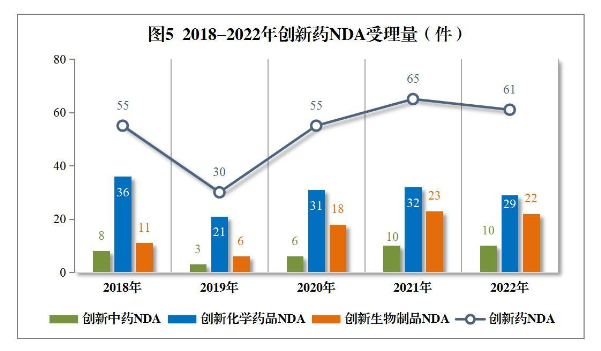
聚焦疾病治疗领域,米内网相关数据显示,今年这些创新药的适应症分布在14个治疗大类中,其中抗肿瘤和免疫调节剂、消化系统及代谢药、心脑血管系统药物霸榜前三位,占整体总量逾七成。这三大领域治疗药物突出的申报亮点,在一定程度上揭示出当前国内外药企的新药研发趋势。
01
EGFR-TKI开发独领风骚
PD-(L)1依旧活跃在一线
肺癌是目前全球发病率第二、死亡率第一的恶性肿瘤,面对临床未尽之需,今年以来有8款NDA的创新药将适应症明确聚焦在这一治疗领域。其中,靶向表皮生长因子受体(EGFR)靶点仍受到热捧,以6个受理号涉及的3款创新药居于靶点开发首位,包括贝达药业的甲磺酸贝福替尼胶囊,迪哲医药的舒沃替尼片,以及晨泰医药的盐酸佐利替尼片。
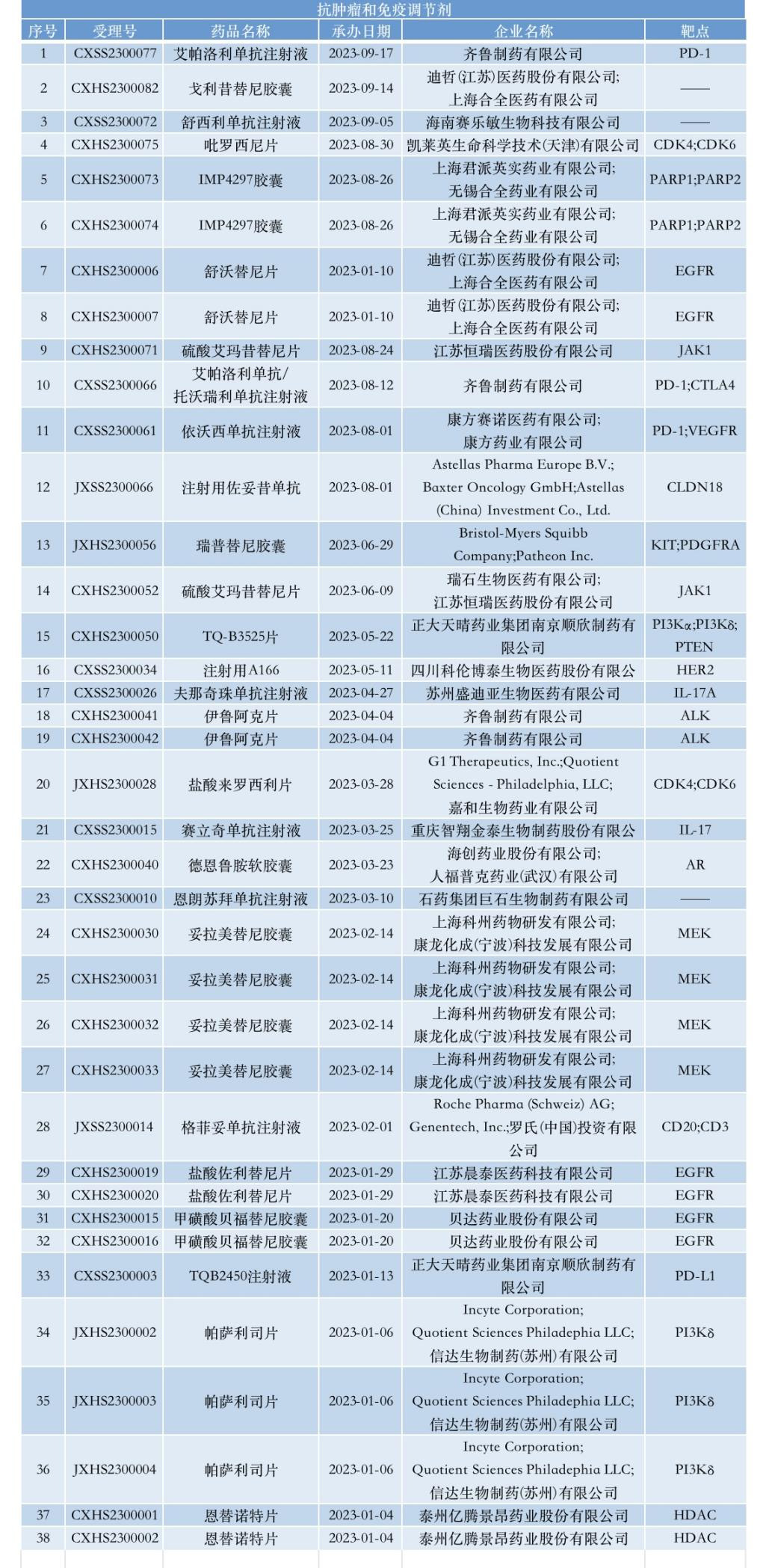
作为经典肿瘤靶点,EGFR抑制剂诞生至今已经历过三个代际,进入差异化竞争时代,这在上述3款创新药身上得到集中体现。其中,甲磺酸贝福替尼胶囊是贝达药业开发的第三代强效、高选择性的小分子口服EGFR-TKI,能够同时结合EGFR敏感突变和T790M突变,目前获批的是二线治疗适应症,适用于既往经EGFR-TKI治疗出现疾病进展,并且伴随EGFR T790M突变阳性的局部晚期或转移性NSCLC患者的治疗。
迪哲医药的舒沃替尼片则是聚焦最常见的EGFR罕见突变类型—EGFR Exon20ins突变。基于突出疗效数据,该药在今年8月获NMPA批准用于既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在EGFR Exon20ins突变的局部晚期或转移性NSCLC的成人患者。在舒沃替尼获批前,全球仅有强生的埃万妥单抗和武田的莫博赛替尼两款获批相同适应症,后者已于今年1月在国内获批上市。
不同于其它TKI类药物,晨泰医药开发的佐利替尼是一款口服、可逆,针对EGFR激活突变(L858R和Exon 19Del)的EGFR-TKI,专为治疗晚期NSCLC伴中枢神经系统转移患者设计,具有完全透过血脑屏障的能力,可以维持在脑组织和脑脊液中高度的药物暴露。据悉,佐利替尼最初由阿斯利康研发,晨泰医药在2017年成立当年便与阿斯利康签订合作协议,通过引进彼时还是先导候选药物的佐利替尼精准切入肺癌脑转移领域,负责推进该产品的II、III期临床开发。
值得一提的是,免疫检查点PD-(L)1的身影依旧活跃在研发一线,今年已有四款相关创新药申报NDA。今年8月,康方生物开发的依沃西单抗注射液的上市申请获得NMPA受理,这是全球首款PD-1/VEGF双抗,在康方生物的TetraBody技术平台上构建,能够同时发挥免疫治疗和血管增生抑制的作用机制。2022年12月,康方生物与Summit Therapeutics达成合作协议,将依沃西单抗在美国、加拿大、欧洲、日本的权益授权给后者,后者支付5亿美元预付款,45亿美元里程碑金额,以及低双位数比例的销售分成。
此外,齐鲁制药申报的靶向PD-1的IgG4抗体艾帕洛利单抗(iparomlimab)注射液NDA在今年9月获得受理,该药物正在被开发用于治疗各种癌症。此前在8月,艾帕洛利单抗与靶向CTLA-4的IgG1抗体托沃瑞利单抗(tuvonralimab)组成的免疫治疗组合抗体QL1706亦在中国申报上市。据悉,QL1706可同时抑制PD-1和CTLA-4,并且CTLA-4抗体成分在体内具有更短的清除半衰期、在一个给药周期内抗体暴露时间较短。
来自正大天晴重点在研的抗肿瘤新药TQB2450注射液其NDA在今年1月获CDE受理。TQB2450是正大天晴开发的一种全新序列的PD-L1的人源化单抗,其已在中国获批开展多项临床试验,其中多个适应症进入3期临床,除了非小细胞肺癌外,还包括复发铂耐药卵巢癌、三阴乳腺癌、头颈部鳞状细胞癌等。早期多项探索临床数据表明,TQB2450联合盐酸安罗替尼胶囊可对多个瘤种起到协同增效作用。这意味着该药或将成为继派安普利单抗后,正大天晴又一业绩增长支柱。
02
DPP-4抑制剂竞争白热化
GLP-1领域出现新入局者
米内网数据显示,在2022年中国公立医疗机构化学药终端,消化系统及代谢药销售额超过1500亿元,这让近年来更多“掘金者”涌入这一赛道。
在今年申报NDA的创新药中,消化系统及代谢药的受理号仅次于抗肿瘤和免疫调节剂,其中靶向二肽基肽酶-IV(DPP-4)靶点的最多,达到7个受理号,涉及4家药企的4款创新药。
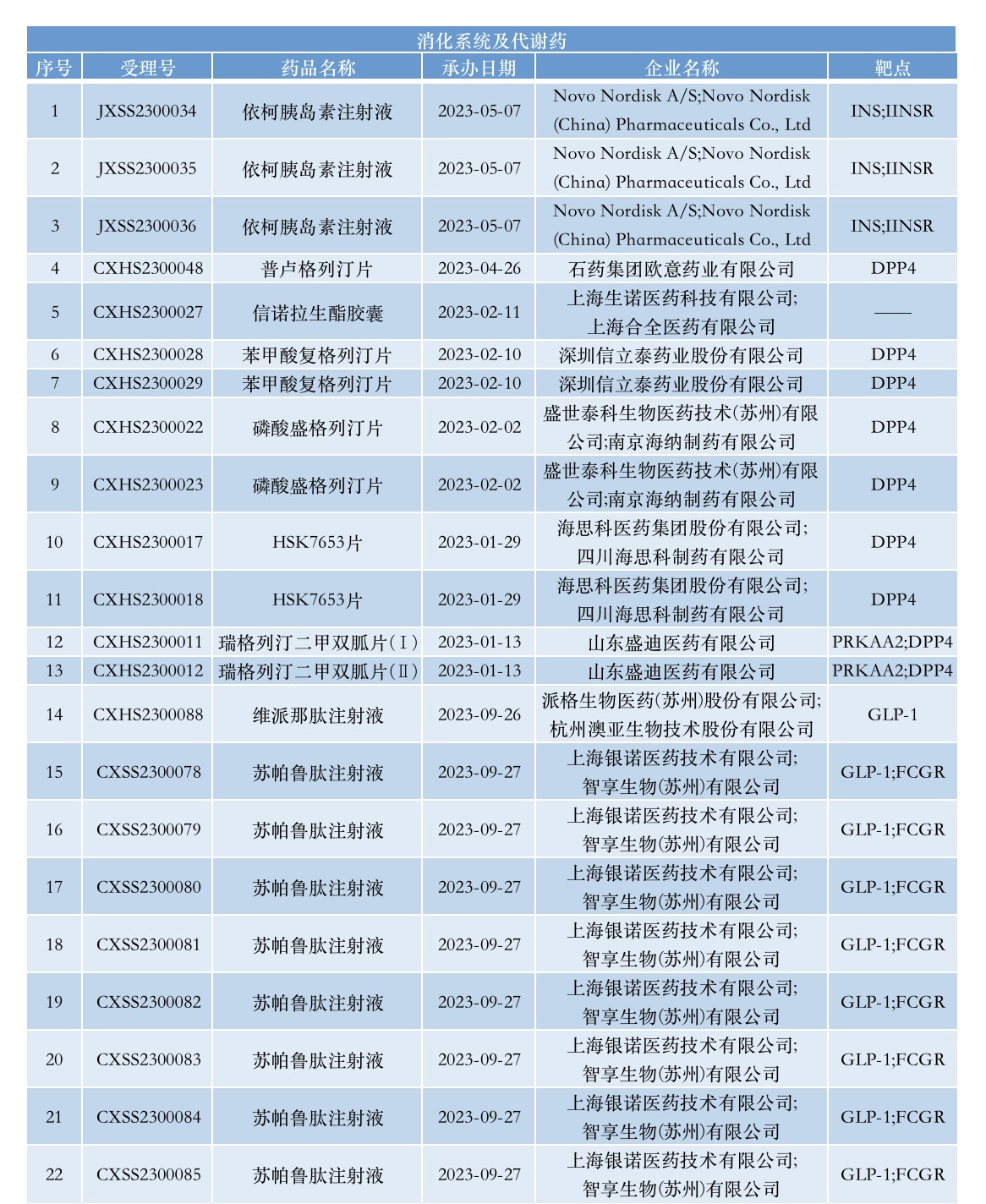
DPP-4抑制剂是一类重要的2型糖尿病治疗药物,主要通过抑制DPP-4酶对胰高血糖素样肽-1(GLP-1)的降解,促进胰岛素葡萄糖依赖性分泌,抑制胰高血糖素分泌来发挥降糖作用,其可以改善β细胞功能紊乱,同时不增加患者的低血糖风险和体重。这类药物已被2020版《中国2型糖尿病防治指南》推荐单药或联合胰岛素,用以控制2型糖尿病患者的血糖。
今年1月,海思科长效DPP-4抑制剂HSK7653片NDA获得CDE受理,预计有望成为全球首个上市DPP-4双周制剂。临床试验结果显示,HSK7653没有胃肠道不良反应且不会引起体重的增加,可在有效降糖的同时不增加低血糖和心血管事件的发生率,在轻中度肝、肾功能损伤患者中也无需调节剂量。作为口服治疗2型糖尿病的双周制剂,HSK7653有望为糖尿病长期管理提供理想的用药选择。
随后在2月,盛世泰科自主研发的新一代高选择性DPP-4抑制剂盛格列汀亦获受理。该药物曾先后入选国家十二五及十三五“重大新药创制”专项。Ⅲ期临床试验结果显示,盛格列汀低剂量即可达到预设试验终点,高剂量组还能很好地显示药物安全性,“量半功倍”的治疗效果让其有望成为同类最佳的降糖药物。随后,信立泰的苯甲酸复格列汀片和石药集团的普卢格列汀片(DBPR108)的NDA也同样获CDE受理,前者具有口服吸收迅速、半衰期长、作用持久等特点,后者作为新型口服DPP-4抑制剂,对DPP-4具有高选择性和强抑制性。
需要注意的是,DPP-4抑制剂市场竞争趋于白热化,6款原研进口的DPP-4抑制剂目前均已在国内上市,包括默沙东的西格列汀、诺华的维格列汀、BMS/阿斯利康的沙格列汀、武田的阿格列汀、勃林格殷格翰/礼来的利格列汀及田边三菱/第一三共的替格列汀。随着国产创新药上市在即,持续内卷的DPP-4抑制剂市场竞争格局或将得到重塑。
此外,风光无两的GLP-1领域也出现了两位新的入局者。9月26日,派格生物自主研发的胰高血糖素样肽1(GLP-1)激动剂维派那肽注射液的NDA获得NMPA受理,拟用于成人2型糖尿病患者的血糖控制。维派那肽是派格生物自主研发的1类创新药物,属于长效GLP-1受体激动剂。该药物具有补充滴定、每周一次、一次性预填充自动注射笔皮下药物等优势,患者的病情从性与生活质量上得到显著改善。
9月27日,银诺医药递交的苏帕鲁肽注射液NDA获CDE受理。公开资料显示,苏帕鲁肽是一款人源化长效GLP-1受体激动剂,不仅可以促进胰岛素的分泌,还能促进β细胞再生,提升β细胞质量,此外还具有较好的人类同源性和临床适用性,且其安全窗口大药效良好。目前,苏帕鲁肽每周一次用于2型糖尿病治疗的Ⅲ期研究已达到主要疗效终点,其还在肥胖和非酒精性脂肪性肝炎(NASH)等代谢病领域开展相关临床研究。
03
PCSK9抑制剂加速竞逐
降血脂市场迎新一轮洗牌
当前,我国心血管疾病管理工作任重而道远。其中,强化血脂管理是实现健康中国战略目标的重要一环,这也让前蛋白转化酶枯草溶菌素9(PCSK9)成为今年创新药NDA申报最热门的靶点,除未明确作用靶点的21个受理号外,其以9个受理号排在首位,涉及君实生物的昂戈瑞西单抗、恒瑞医药的瑞卡西单抗和康方生物的伊努西单抗这3款PCSK9抑制剂。
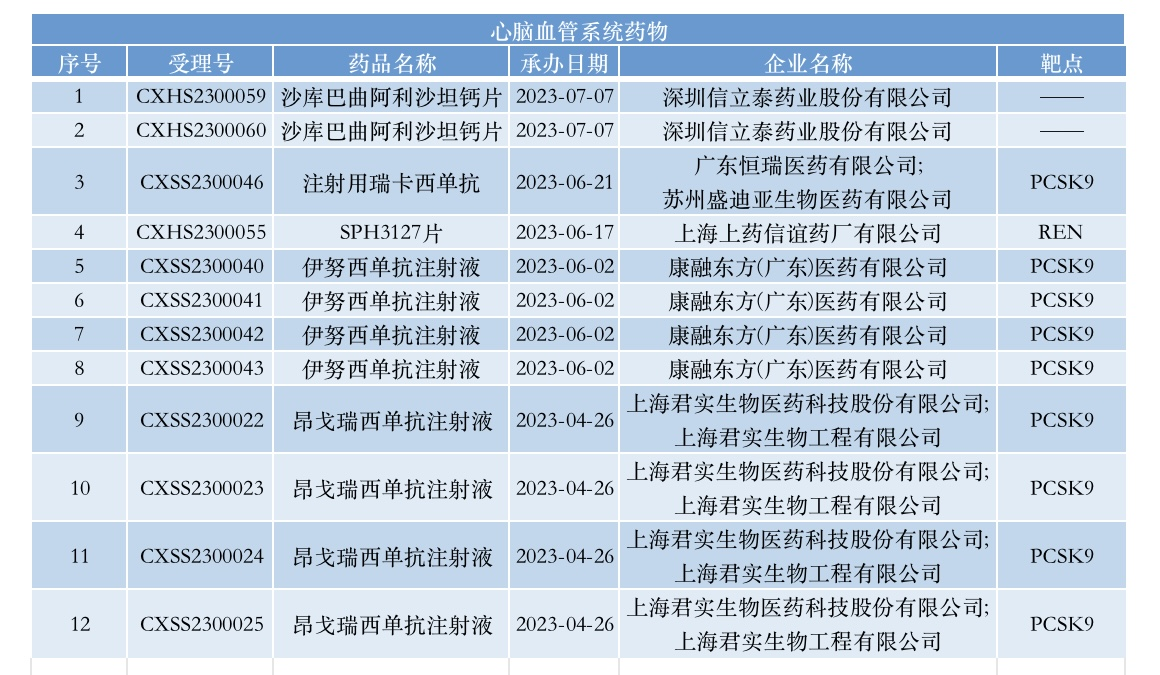
君实生物是为数不多在今年交出两个创新药NDA的biotech,除了成功推动与苏州旺山旺水共同研发的口服核苷类抗新冠病毒药物氢溴酸氘瑞米德韦片(VV116)上市以外,其还递交了自主研发的重组人源化抗PCSK9单克隆抗体注射液昂戈瑞西单抗(JS002)两项高胆固醇血症适应症的上市申请,在今年4月获CDE受理,这也是其慢性代谢管线中首款进入商业化申报阶段的产品。
作为强效降低LDL-C水平的新型降脂药物,PCSK9抑制剂已得到国内外血脂管理指南的推荐。在国内,PCSK9抑制剂这条明星降脂药赛道已有四款药物获批上市,分别是安进的依洛尤单抗、赛诺菲的阿利西尤单抗、诺华的英克司兰钠以及信达生物的托莱西单抗,后来者君实生物将直面焦灼的市场竞争。值得一提的是,国家知识产权局近日宣告了君实生物挑战诺华PCSK9抑制剂专利失败的消息,这让昂戈瑞西单抗未来获批上市后能否顺利生产销售增加了不确定性。
此外,康方生物子公司康融东方(广东)医药有限公司开发的伊努西单抗注射液(AK102)的NDA在今年6月亦获NMPA受理,拟用于两项适应症的治疗,包括原发性高胆固醇血症和混合型高脂血症,以及杂合子型家族性高胆固醇血症(HeFH)。本次新药上市申请主要基于4项关键注册性研究,包括3项针对原发性高胆固醇血症和混合型高脂血症患者的关键注册性临床研究,以及1项针对HeFH患者的关键注册性临床研究。
在同月,恒瑞医药子公司广东恒瑞医药有限公司提交的注射用瑞卡西单抗NDA申请获NMPA受理,成为第4款申报NDA的国产抗PCSK9单抗。截至彼时公告,恒瑞医药该项目累计已投入研发费用约2.47亿元。目前,瑞卡西单抗共计已完成了多项临床研究,为上市申报提供了充足的临床数据支持。基于给药频率更灵活的优势,瑞卡西单抗或可为患者提供新的治疗选择。
相比于传统且已被纳入国家集采的他汀类药物,PCSK9抑制剂的价格高出很多,这也是目前制约PCSK9抑制剂市场份额快速扩增的主要原因。不过,根据米内网统计,安进的依洛尤单抗和赛诺菲的阿利西尤单抗这2款进口抗PCSK9单抗,在2022年合计销售额超过9亿元。随着多家国内制药企业在PCSK9抑制剂的开发上开始竞逐,降血脂药物市场新一轮洗牌即将来袭。
总 结
截至目前,上述65个创新药已有6款获得批准上市,包括贝达药业的甲磺酸贝福替尼胶囊,上海旺实生物医药的氢溴酸氘瑞米德韦片,先声药业的先诺特韦片/利托那韦片组合包装,众生睿创生物的来瑞特韦片,齐鲁制药的伊鲁阿克片,以及迪哲医药的舒沃替尼片。还有更多新药将在未来1~2年迎来上市里程碑。

自2015年药品审批制度改革以来,我国创新药产业实现了飞速发展,向创新转型升级是各大药企的战略举措。不过在现阶段,创新药研发领域的主力军仍然是biotech,今年以来创新药的NDA形势便是其中的一道缩影。随着药审改革逐步深入以及鼓励创新的政策持续推动,未来几年我国创新药上市将迎来大爆发。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx