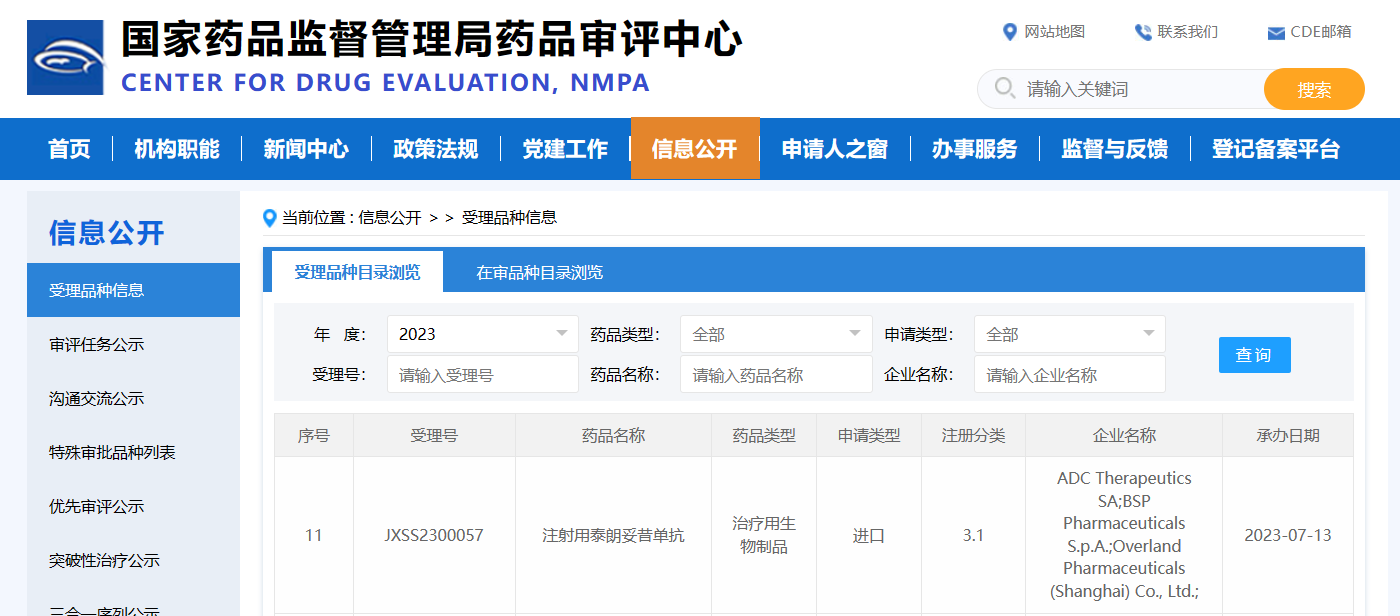
7月13日,CDE官网显示,瓴路药业/ADC Therapeutics在研的靶向CD19抗体偶联药物(ADC)注射用泰朗妥昔单抗(Loncastuximab tesirine)上市申请获得受理,适应症单药治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)。这也是国内首个申报上市的靶向CD19的ADC药物。
 Loncastuximab tesirine是一款CD19靶向ADC,当该药物与表达CD19的肿瘤细胞结合时,会被细胞内化,随后释放吡咯并苯二氮杂䓬二聚体(PBD)细胞毒素。PBD通过与DNA小沟结合,形成强效的细胞毒性DNA链间交联,导致DNA复制停滞,阻断细胞周期从而导致肿瘤细胞死亡。本次上市申请是基于II期OL-ADCT-402-001研究的积极数据。OL-ADCT-402-001是一项开放性、单臂的II期研究,旨在评估Loncastuximab tesirine单药用于治疗复发/难治性弥漫大B细胞淋巴瘤中国患者的有效性和安全性。该研究主要终点为总体缓解率(ORR),次要终点为缓解持续时间(DOR)、完全缓解(CR)率及无进展生存期(PFS)等。2023年4月,瓴路药业宣布OL-ADCT-402-001研究达到了主要终点,并证明了Loncastuximab tesirine的有效性与安全性数据与全球关键临床ADCT-402-201的结果一致。此外,瓴路药业目前正在中国开展另一项评估Loncastuximab tesirine联合利妥昔单抗(Lonca-R)对比利妥昔单抗联合吉西他滨及奥沙利铂(R-GemOx)的疗效和安全性的确证性III期ADCT-402-311研究,这也是Loncastuximab tesirine的全球确证性III期注册临床试验。Loncastuximab tesirine已于2021年4月获FDA加速批准上市,单药治疗此前至少接受过2线及以上系统治疗后复发或难治性DLBCL成人患者,包括非特定类型的DLBCL、低分化淋巴瘤引起的DLBCL和高分化B细胞淋巴瘤引起的DLBCL。该药物是首个也是唯一一个获批治疗DLBCL的靶向CD19的ADC药物。
Loncastuximab tesirine是一款CD19靶向ADC,当该药物与表达CD19的肿瘤细胞结合时,会被细胞内化,随后释放吡咯并苯二氮杂䓬二聚体(PBD)细胞毒素。PBD通过与DNA小沟结合,形成强效的细胞毒性DNA链间交联,导致DNA复制停滞,阻断细胞周期从而导致肿瘤细胞死亡。本次上市申请是基于II期OL-ADCT-402-001研究的积极数据。OL-ADCT-402-001是一项开放性、单臂的II期研究,旨在评估Loncastuximab tesirine单药用于治疗复发/难治性弥漫大B细胞淋巴瘤中国患者的有效性和安全性。该研究主要终点为总体缓解率(ORR),次要终点为缓解持续时间(DOR)、完全缓解(CR)率及无进展生存期(PFS)等。2023年4月,瓴路药业宣布OL-ADCT-402-001研究达到了主要终点,并证明了Loncastuximab tesirine的有效性与安全性数据与全球关键临床ADCT-402-201的结果一致。此外,瓴路药业目前正在中国开展另一项评估Loncastuximab tesirine联合利妥昔单抗(Lonca-R)对比利妥昔单抗联合吉西他滨及奥沙利铂(R-GemOx)的疗效和安全性的确证性III期ADCT-402-311研究,这也是Loncastuximab tesirine的全球确证性III期注册临床试验。Loncastuximab tesirine已于2021年4月获FDA加速批准上市,单药治疗此前至少接受过2线及以上系统治疗后复发或难治性DLBCL成人患者,包括非特定类型的DLBCL、低分化淋巴瘤引起的DLBCL和高分化B细胞淋巴瘤引起的DLBCL。该药物是首个也是唯一一个获批治疗DLBCL的靶向CD19的ADC药物。Copyright © 2023 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx