摘要:“7.22”惨案重现?
近日,国家药品监督管理局食品药品审核查验中心(CFDI)发布了关于公开征求《药物临床试验机构监督检查要点和判定原则(征求意见稿)》意见的通知。
看到这一通知,笔者瞬间就想到了8年前的“7.22”惨案。
2015年07月22日,国家食品药品监督管理局发布关于开展药物临床试验数据自查核查工作的公告(2015年第117号),此公告一经发出,很快出现多例临床数据造假事件,紧接着,造假事件被惩戒处理的同时,又有多家申请人主动撤回注册申请,业内一度秩序混乱,连锁反应不断。
2015年NMPA针对临床试验机构的数据核查,造成了声名狼藉的“7.22”惨案,如今CFDI对临床试验机构再次出手干预控盘,不知是利好还是利空?
药物临床试验机构监督检查要点和判定原则来袭
该征求意见稿共包括检查要点17个,检查项目105个,可分为机构部分和专业部分两大方向。其中关键项目共计9项,采用“★★”标识,主要项目共计43项,采用“★”标识,一般项目共计53项,无特殊标识。关键项目,也即含“★★”标识检查项不符合要求的可判为严重缺陷。主要项目,也即含“★”标识检查项不符合要求者可判为主要缺陷。一般项目不符合要求者可判为一般缺陷。
那么如果临床试验中出现了不同程度的缺陷,会造成什么样的后果?这就类似于对犯人进行量刑,多大的错误决定你最后所判的年限,而缺陷的严重程度决定了临床试验是否符合要求。
具体规定为:临床试验中,只要有一项严重缺陷,即临床试验不符合要求。如果临床试验中有三项以上的主要缺陷,那么该临床试验也是不符合要求的。
如果临床试验发现少于5项一般缺陷,但是这些缺陷不影响受试者的安全或试验数据质量,同时质量管理体系比较健全,此时可判定为符合要求。如果发现的一般缺陷多于或等于5项,或者未发现严重缺陷,只存在主要缺陷,但数量少于或等于3项,经综合研判,所发现缺陷可能影响受试者安全和/或试验数据质量,但质量管理体系基本健全的,结论为基本符合要求。
以下为该征求意见稿所涉及的9项严重缺陷,做药物临床试验前一定要严格把控,这9项中的任意一项都是临床试验中不可触碰的的红线,触之必死。
从下表1中可看出,该征求意见稿对于机构部分的针对性要更强一些,9项“★★”检查项目中有6项是关于机构部分的。其中对于资质条件的把控最为严格,共涉及5项“★★”检查项目。所以在做临床试验之前,对临床试验机构的资质核查一定是重中之重,这样既可以保证受试者的安全,同时也可以保证临床试验符合要求。此外临床试验机构应配合监管部门的检查,无正当理由不得拒绝,并且在备案平台完成登记备案,备案完成后方可进行临床试验。
表1 药物临床试验机构监督检查要点-机构部分(“★★”),表格来源:《药物临床试验机构监督检查要点和判定原则(征求意见稿)》

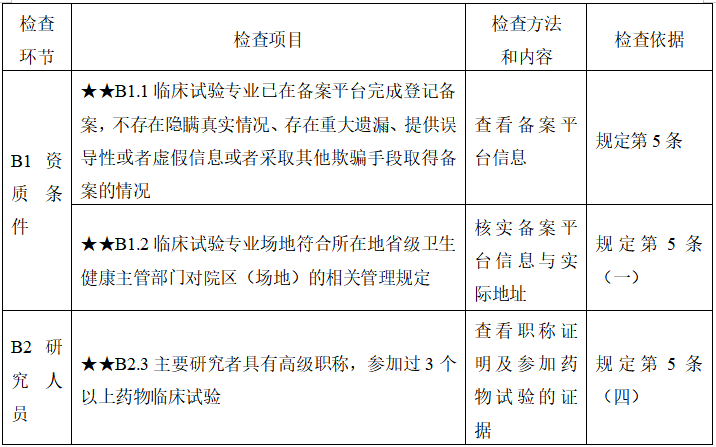
下表2为专业部分的检查要点,共涉及3项“★★”级检查项目。其中两项关于资质条件,需要临床试验专业已在备案平台完成登记备案,临床试验专业场地符合所在地省级卫生健康主管部门对院区(场地)的相关管理规定。此外对于主要研究人员要求具有高级职称,并参加过3个以上药物临床试验。
对于专业部分方面,重点就在于场地以及主要研究人员的专业性,进而确保受试者的安全以及数据的可靠性。
表2 药物临床试验机构监督检查要点——专业部分(“★★”),表格来源:《药物临床试验机构监督检查要点和判定原则(征求意见稿)》
从该政策分析我国临床试验当前存在的问题
我国临床试验存在的主要问题可以概括为两大方面,即研究机构方问题与申办者方问题。
首先对于研究机构,许多医院对于临床试验部门的定位并不清晰,同时一些研究机构资质并不健全。一些医院对于临床试验部门的人员配置具有较强的随意性,对于人员的配置情况完全取决于对该药的重视程度,有些甚至只是为应付国家药监部门的检查而临时拼凑,这也造成了临床试验质量参差不齐。所以《药物临床试验机构监督检查要点和判定原则(征求意见稿)》对于机构的临床试验专业资质以及主要研究人员的资质有了严格的要求。
其次就是申办方临床试验质量责任主体意识比较淡漠。从最开始对临床试验机构的选择以及资质核查,到建立药物临床试验的质量管理体系,再到试验期间委派临床试验监查员对机构的监察,都与申办者息息相关。但是我国一些申办者只是发起临床试验并提供研究经费,其余一切都置之不理,更有甚者与机构串通一气,修改临床试验数据。
以NMPA2017年发布的《药物临床试验数据核查阶段性报告》为例,其中申请人主动撤回注册申请1316个,并查出38个注册申请的临床数据造假,对于这些有问题的注册申请,无论是试验机构还是申请者,恐怕都是心知肚明。
“7.22”惨案是否将重现?
对于“7.22”惨案是否将重现这个问题,我们可以从两次发布公告内容的严苛程度进行判断。
对于2015年11月10日发布的《药物临床试验数据现场核查要点》,公告中明确告知了对于弄虚作假等行为,如若发现,相关责任人将进行严肃处理,对于发现问题并主动撤回的,可免予责任追究。

图1 药物临床试验数据现场核查要点公告
图片来源:NMPA
而近期发布的《药物临床试验机构监督检查要点和判定原则(征求意见稿)》,从惩罚的严厉程度上是不及《药物临床试验数据现场核查要点》的,公告中并未说明对于违规机构的惩罚措施。
但该项征求意见稿发布后,无论试验机构还是申请人,都需敲响警钟。毕竟只要触碰到其中的9条红线之一,就意味着临床试验不符合要求。

图2 药物临床试验机构监督检查要点和判定原则通知
小 结
临床试验关乎着药物的安全性以及有效性,近年来我国对于临床试验的管控逐渐严格。希望无论是试验机构还是申请人,都抱有负责以及严谨的态度,伴随着法规制度的日渐完善,我国的临床试验数据能够真实可靠,走向全球,未来的新药研发可以蓬勃发展。
参考文献
[1]《药物临床试验机构监督检查要点和判定原则(征求意见稿)》.
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx