6月5日,诺华的「盐酸伊普可泮胶囊」被CDE拟纳入优先审评,用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。
盐酸伊普可泮(iptacopan,LNP023)是诺华研发的首 个靶向补体旁路途径B因子的口服抑制剂,作用于补体系统C5末端通路的上游,同时控制血管内溶血和血管外溶血,弥补了抗C5抗体的不足,被开发用于治疗多种补体介导疾病,如阵发性睡眠性血红蛋白尿症(PNH)、C3肾小球病(C3G)、IgA肾病(IgAN)、非典型溶血性尿毒症综合征(aHUS)、膜性肾病(MN)、狼疮性肾炎(LN)以及免疫性血小板减少性紫癜(ITP)和冷凝集素病(CAD)等。
2023年5月,诺华宣布评估iptacopan单药治疗未接受过补体抑制剂(包括抗C5抗体)治疗的PNH成人患者疗效和安全性的3期临床试验达到主要终点。该研究是一项单臂、开放标签、多中心研究,共入组40例平均血红蛋白(Hb)<10g/dL、乳酸脱氢酶(LDH)>1.5x正常值上限且未接受过补体抑制剂治疗的成人PNH患者。
结果显示:试验达到主要研究终点,92.2%患者在不输注红细胞(RBCT)情况下达到血红蛋白水平较基线升高≥2g/dl。次要终点也显示出临床意义上的改善,如62.8%的患者在RBCT情况下血红蛋白水平较基线升高≥12g/dl,97%的患者避免输血。
在国内,iptacopan先后于2022年3月和2023年2月被CDE纳入突破性治疗品种,分别用于治疗 C3肾小球病(C3G)和阵发性睡眠性血红蛋白尿症(PNH)。此次iptacopan被CDE纳入优先审评,将进一步加速其PNH适应症在国内的获批上市。
关于PNH及其治疗进展
阵发性睡眠性血红蛋白尿症(PNH)是一种罕见的获得性克隆性造血干细胞疾病,全球发病率约为1~2/百万, 亚洲地区发病率相较西方高。PNH是由于患者造血干细胞的PIG-A基因突变,使部分或完全血细胞膜糖化磷脂酰肌醇(GPI)锚合成障碍,造成血细胞表面的GPI锚连蛋白(如补体调节蛋白CD55、CD59)缺失,细胞灭活补体能力减弱,从而引起细胞被破坏和发生溶血等。PNH患者的临床表现主要为不同程度的发作性血管内溶血、阵发性血红蛋白尿、骨髓造血功能衰竭和静脉血栓形成。
补体系统是机体固有免疫的组成部分。在补体介导的溶血反应中,补体激活早期阶段被称为近端通路。PNH患者的红细胞因CD55缺乏导致C3裂解增多,C3a和C3b的形成增加,C3b介导的调理作用使红细胞在脾和肝 脏被吞噬,导致血管外溶血(EVH)。C3a及C3b形成后产生的补体级联反应被称为远端通路。PNH患者的红细胞因CD59的缺乏使C5b更多的转化为膜攻击复合物(MAC),导致红细胞直接裂解,即血管内溶血(IVH)。
抗C5是公认的PNH标准治疗。目前,全球监管机构已批准3款PNH药物,即Soliris(依库珠单抗,阿斯利康/Alexion)、Ultomiris(ravulizumab,阿斯利康/Alexion)和Empaveli (pegcetacoplan,Apellis公司),其中仅Soliris在国内获批上市。
• Soliris是全球首 个获批的C5补体抑制剂,通过选择性抑制末端补体C5蛋白质的激活来发挥作用,2007年3月被FDA批准用于治疗PNH,随后又被批准用于治疗非典型溶血性尿毒症综合征(aHUS)、抗乙酰胆碱受体(AchR)抗体阳性的难治性全身型重症肌无力(gMG)和抗水通道蛋白-4(AQP4)抗体阳性的成年患者的视神经脊髓炎症(NMOSD)。
• Ultomiris是Soliris的升级版,是第一种每8周给药一次的长效C5补体抑制剂,2018年12月被FDA批准用于治疗PNH,随后又被批准用于治疗aHUS、gMG和NMOSD。
• Empaveli是FDA批准的首 个治疗PNH的补体C3靶向疗法,它是一种合成的环肽,与聚乙二醇聚合物偶联,特异性结合于C3和C3b。2021年5月,Empaveli 被FDA批准用于治疗未经治疗的成人PNH患者,以及既往接受过补体C5抑制剂Soliris (依库珠单抗)和Ultomiris (ravulizumab)治疗的PNH患者。
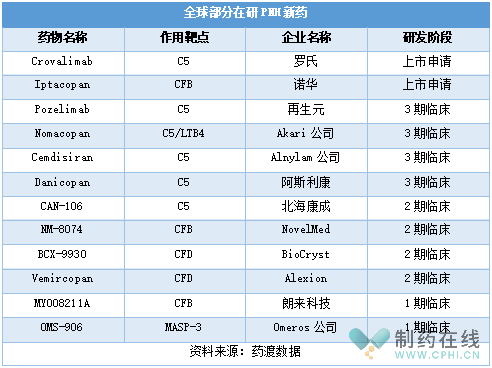
此外,目前全球还有多款在研PNH新药,详见下表。作用靶点上,除了C5,在研PNH新药靶点还涉及CFB、CFD等。药物类型上,除了单抗和环肽,还包括RNAi药物,如Cemdisiran。
研发进度上,罗氏的Crovalimab和诺华的Iptacopan进展较快。2022年8月Crovalimab治疗PNH的上市申请获CDE受理,且被纳入优先审评。Crovalimab是罗氏通过连续单克隆抗体回收技术(Smart-Ig)工程化改造自主研发的的新一代C5抑制剂,可以阻断补体C5裂解为C5a和C5b。
与已批准的C5抑制剂相比,Crovalimab高度可溶,提供持续完整的末端补体途径抑制,允许小剂量皮下注射(1-4 mL),可每月一次给药,同时作为皮下注射剂,患者可以在家自行给药,大大提升了依从性;其特异性靶向表位,能覆盖到更多临床情形的PNH患者,并表现出良好的耐受性和可接受的安全性。
此外,目前全球还有多款在研PNH新药进入后期临床,如Pozelimab、Nomacopan等。预计不久的将来,PNH领域将迎来更多治疗选择。
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx