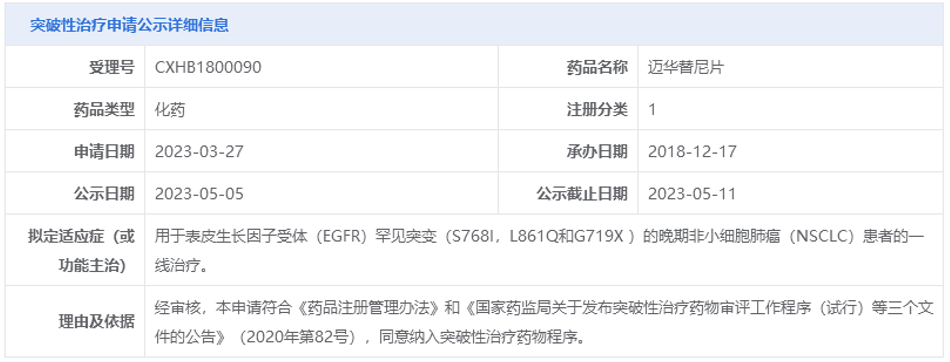
近日,中国国家药品监督管理局药品审评中心(CDE)官网最新公示,由华东医药全资子公司中美华东申报的1类新药迈华替尼片纳入突破性治疗品种,针对适应症为:用于表皮生长因子受体(EGFR)罕见突变(S768I,L861Q和G719X)的晚期非小细胞肺癌(NSCLC)患者的一线治疗。
迈华替尼是华东医药从苏州迈泰生物引进的第二代不可逆EGFR/HER2高效双重抑制剂,具有高活性,高水溶性特点,对第一代EGFR TKIs产生的耐药性有很好的治疗效果。
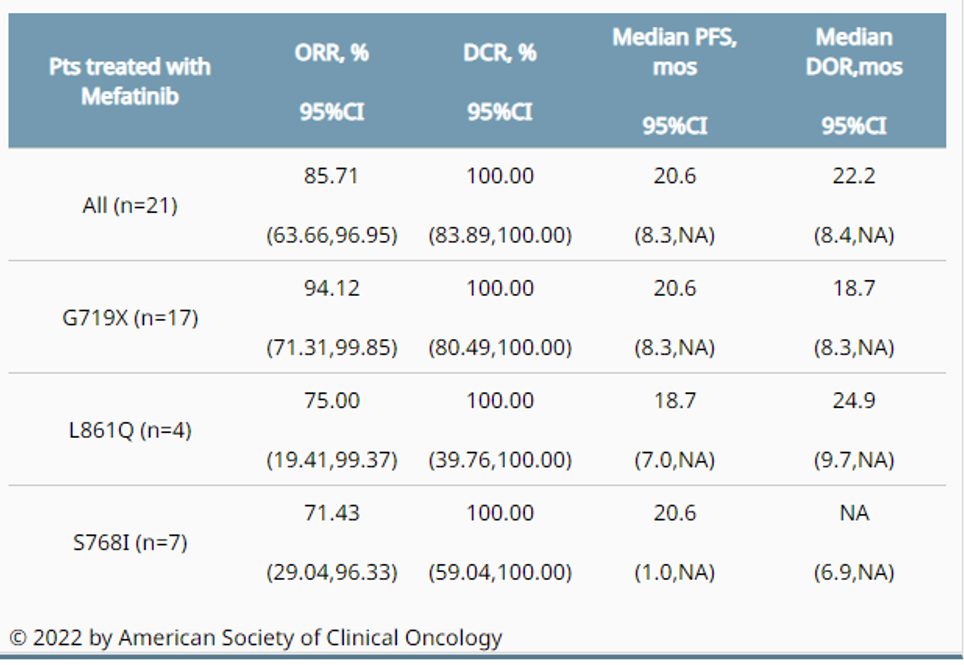
迈华替尼一线治疗EGFR罕见突变非小细胞肺癌患者的2期临床研究以 POSTER形式发表于2022年ASCO 会议,该研究旨在评估迈华替尼作为晚期罕见EGFR突变(G719X/S768I/L861Q) NSCLC一线治疗的有效性和安全性。此次共纳入21例患者(中位年龄57.6岁,男性47.62%),其中80.95%为G719X, 33.3%为S768I, 19.05%为L861Q。6例(28.57%)患者同时存在G719X和S768I突变,1例(4.76%)患者同时存在G719X和L861Q突变。截至数据截止(2022年1月6日),中位随访时间为25.1个月。在21例可评估疗效的患者中,ORR为85.71% (95% CI, 63.66-96.95),反应持续时间(DOR)为22.2个月(95% CI, 8.4 na)。疾病控制率(DCR)为100% (95% CI, 83.89 ~ 100.00)。中位无进展生存期(mPFS)为20.6个月(95% CI, 8.3 na)。中位总生存期(OS)未达到。最常见的治疗相关不良事件(TRAEs)为皮疹(20例,95.24%)、腹泻(19例,90.48%)、口炎(15例,71.43%)和pandactitis(9例,42.86%)。33.33% (n=7)的患者因不良反应(主要是腹泻和皮疹)而出现剂量减少。所有TRAEs都是可逆的,在减少剂量后保持稳定或恢复无后遗症。没有患者因TRAE而停止治疗或死亡。
华东医药正在开展一项随机、平行、双盲双模拟、多中心的3期临床,探索迈华替尼对比吉非替尼一线治疗EGFR敏感突变的晚期非鳞状NSCLC的安全性和有效性。迈华替尼片已经于2021年6月完成3期临床末例受试者入组,目前正在进行PFS事件数随访,预计2023年第二季度获得3期研究PFS事件数后开展上市申报工作。
EGFR罕见突变 :G719X、S768I和L861Q
在NSCLC患者中,EGFR突变是最常见的基因突变之一。其中19外显子缺失(Exon19 del)和21外显子 L858R(Exon21 L858R)突变约占所有突变类型的80%-90%,称为经典突变,对酪氨酸激酶抑制剂(TKI)敏感,用TKI治疗相比传统化疗有更长的PFS。
但约有10%的EGFR突变NSCLC患者具有罕见突变,如:G719X、S768I和L861Q。18外显子G719X(包括G719S、G719A、G719C和G719D替换)、20外显子S768I和21外显子L861Q突变。这些突变分别占NSCLC中所有EGFR突变的3%、1%和1%。相比经典突变,罕见突变的总生存期更短,TKI缓解率更低。因此,这部分患者仍然存在未被满足的治疗需求。临床前研究表明,对于主要的非经典突变,二代和三代EGFR TKIs比一代EGFR TKIs更敏感。
阿法替尼和奥希替尼被NCCN推荐
LUX-Lung2、3和6试验的罕见突变队列分析表明:在75例接受阿法替尼治疗的EGFR罕见突变患者中,G719X(n=18)、L861Q(n=16)和S768I(n=8)患者的客观缓解率(ORR)分别为78%、56%和100%,中位无进展生存期(PFS)分别为13.8、8.2和14.7个月。
基于此研究,2018年1月16日,FDA已批准阿法替尼用于转移患者的一线治疗NSCLC,用于肿瘤具有非耐药性罕见EGFR突变(L861Q、G719X和/或S768I)的转移性非小细胞肺癌(NSCLC)患者的治疗,扩大了阿法替尼对非耐药性EGFR突变的使用范围。
一项韩国研究者开展的II期临床研究评估36例罕见EGFR突变患者接受奥希替尼治疗疗效。36例患者中,53%的患者是G719X突变,25%是L861Q突变,22%是S768I突变,1例L747S突变,1例S720A突变,1例18外显子的缺失,1例20号外显子的插入性突变。
36例罕见突变患者接受奥希替尼治疗后,有效率ORR为50%,疾病控制率DCR为89%。中位疗效持续时间DOR是11.2个月,最长的一位患者疗效持续了31个月。78%的患者出现了肿瘤的缩小。
最新NCCN指南中,将约占EGFR 10%的S768I、L861Q及G719X等少见突变的治疗写入指南。一线治疗中,如果检测到这些突变,优先选择阿法替尼或奥希替尼,其次可选择厄洛替尼,吉非替尼或达可替尼。

2022 v1版NCCN指南关于EGFR S768I/G719X/L861突变
国产新药挑战EGFR (G719X、S768I和L861Q)罕见突变
除了此次纳入突破性治疗的迈华替尼,国内还有一款针对EGFR (G719X、S768I和L861Q)突变的药物处于II期临床-马来酸苏特替尼。
苏特替尼是苏州韬略生物研发的一款专门针对罕见、难治EGFR突变的国产二代EGFR-TKI,是阿法替尼的同类药。这款药物在多种对现有的1~3代EGFR抑制剂不敏感的突变,如EGFR L861Q、G719X及S768I突变的治疗中,有一定的潜力。
在苏特替尼的 IIa 期临床试验中,针对携带非耐药性EGFR非经典突变(L861Q、G719X和/或S768I)的非小细胞肺癌,患者每天一次口服 80 毫克苏特替尼进行治疗后,实现 ORR 约 92.9%,初步展现出良好的有效性。次要疗效指标试验数据方面,截至 2021 年 12 月 31 日,疾病控制率(DCR)为 100%,中位缓解持续时间(mDOR)为 12.0 个月,中位无进展生存期(mPFS)为 12.8 个月。
苏特替尼分别于2021年8月和2021年6月分别在中美两地获批开展针对携带非耐药性EGFR非经典突变(L861Q、G719X和/或S768I)的非小细胞肺癌的IIb期单臂关键性临床试验。目前苏特替尼针对EGFR罕见突变的国内关键IIb期临床正在进行中,如果取得阳性结果,苏特替尼极有可能通过该单臂试验结果获得有条件上市,后续再开展确证性临床试验。另外,苏特替尼用于治疗携带非耐药性EGFR非经典突变(E709A、E709K、R776H、G724S、G779F等)或经第三代EGFR抑制剂一线治疗后产生的耐药性EGFR非经典突变(Ex19del-C797S、Ex19del-G796S、Ex19del-L792H、Ex19del-T854I、Ex19del-G724S、L858R-C797S、L858R-L792H、L858R-T854S等)的局部晚期或转移性非小细胞肺癌的II期单臂关键性临床试验也于2022年3月获得FDA批准开展。
结语
EGFR (G719X、S768I和L861Q)等罕见突变NSCLC虽然占比较低,但存在未被满足的临床需求。目前全球只有阿法替尼这一款药物获批用于这类EGFR突变NSCLC,期待更多药企布局入场布局这一领域,打破EGFR罕见突变NSCLC患者少药可用的局面。
参考来源:
1. CDE官网
2. 江苏韬略生物招股书
3. 华东医药顺利发布2023一季报. Retrieved Apr 20,2023, from https://mp.weixin.qq.com/s/-DQ8kY0ABvOYfWcibXod1w
4. Yang JC, Sequist LV, Geater SL, et al. (2015) Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 16:830-838.
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx