5月18日,恒瑞医药发布公告称,根据CFDA药品审评审批最新政策,结合公司实际情况,已提交了撤回聚乙二醇重组人粒细胞集落刺激因子注射液的上市申请,并获得批准。
关于撤回原因,恒瑞给出的解释是:公司按照CFDA相关文件要求对本品临床项目进行深度自查,需对临床试验进行补偿完成研究,现申请撤回。
聚乙二醇重组人粒细胞集落刺激因子注射液在2010 年2月21日被CFDA批准进行临床试验,研究用于降低接受骨髓抑制抗肿瘤药治疗的恶性肿瘤患者中性粒细胞减少的发生率。2013年1月14日,恒瑞向江苏省食品药品监督管理局提交生产注册申请并获受理。截至目前,该研发项目投入研发费用共计 4350 万元。
2015 年全球市场同类产品销售额约为 48亿美元,国内市场同类产品销售额约为 600 万美元。
聚乙二醇重组人粒细胞集落刺激因子注射液撤回之后会怎么办?恒瑞表示,公司将尽快完善相关研发数据并补充申报,同时强调该药品注册申请撤回不会对公司当期及未来生产经营与业绩产生重大影响。
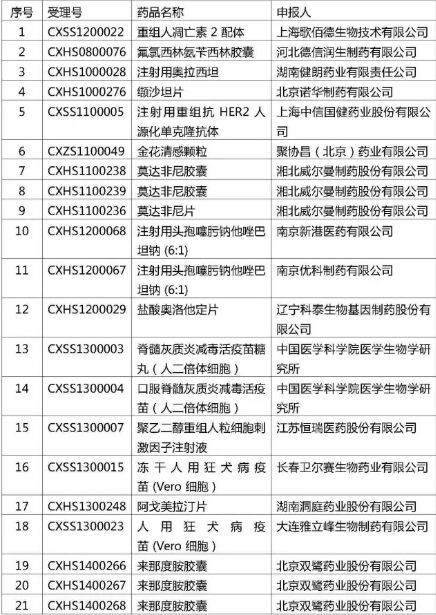
而聚乙二醇重组人粒细胞集落刺激因子注射液位列CFDA在5月4日发布了的<药物临床试验数据现场核查计划公告(第2号)>之中,在名单上还有双鹭药业的来那度胺、中信国健的“国产赫赛汀”。CFDA在公告中称,所列品种在10天公示期内可以主动撤回,公示期结束后,CFDA将对所列品种逐一进行现场核查。今天是公示期中的最后一天。
在不久前,恒瑞董事长孙飘扬曾向CFDA公开喊话“临床核查应区分造假和不规范,处置要明确各方责任,惩罚的‘板子’要打对方向。”彼时,恒瑞申报生产的1.1类新药DPP4抑制剂磷酸瑞格列汀被其宣布撤回。而这一产品是被恒瑞及投资者均看重的重磅级产品,按照之前的研发节奏,有望在2017年左右上市,并成为国内药企中第一个上市的。根据公告,恒瑞对这一产品的研发投入已经达到1.01亿元,属于目前撤回品种中投入最大的之一。
CFDA对于名单之上余下的20个品种,现场核查从明天起即将启动,等待它们的命运会是什么?
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx