作者:阎昭(天津医科大学肿瘤医院)
编辑:春雪
近年来无论是以申请注册为目的的新药临床试验、药物上市后再评价、还是研究者发起的临床研究,都在越来越多地将遗传学研究内容纳入其中。这种研究趋势一方面符合药品审评部门要求尽量搞清新药作用机制的政策导向,另一方面也符合在规范化医疗的基础上向个体化、精准化医疗方向迈进的发展趋势。然而,对于这些临床试验中附带遗传学研究的样本收集和知情同意的实施过程却存在着大量不尽合理的现象,有待分析和讨论。
1.什么情况下一项临床试验可以附带遗传学研究,什么情况下不可以?
(1)首先要明确附带遗传学研究是一项对未明机制的探索性研究还是对已知机制的确证性研究?
(2)如果是对未明机制的探索性研究就完全脱离了本项临床试验的研究范围,而成为依托本项临床试验开展的多中心样本收集活动。
l支持者认为:能够借助大规模、多中心临床试验收集目标人群的生物样本是促进医学基础研究的良机,如果都不热心支持将严重阻碍相关基础研究进步
l反对者认为:这样的收集活动超出临床试验原本的目的,给受试者的参与设置了附加条件,且缺乏对该类基础研究科学性和可行性的严肃的审核程序
(3)如果是对已知机制的确证性研究,就可以归为伴随标志物研究
l需明确为哪一类的标志物研究:预后标志物、预测标志物、替代终点标志物?
l是否根据标志物的类型事先制定了统计计划和样本量评估?

2.附带遗传学研究是否有明确的目的、合理的依据、严格的样本使用与管理规范
(1)研究目的不明确是目前临床试验附带遗传学研究中存在的普遍问题;
(2)前期基础研究工作不足,甚或仅触发于国外文献/会议报道,导致立题依据不足;
(3)由于仓促上马、缺乏实验室技术人员指导、未事先制定缜密的SOP、未对一线取样人员进行严格培训、未事先对样本采集的流程进行模拟测试^,以上诸多因素的汇集效应就是→结果可信度低→进而导致标本资源的浪费!
摄于周宏灏院士报告现场
(4)以上问题导致中国迄今还未得到公认有临床指导意义的遗传学研究成果
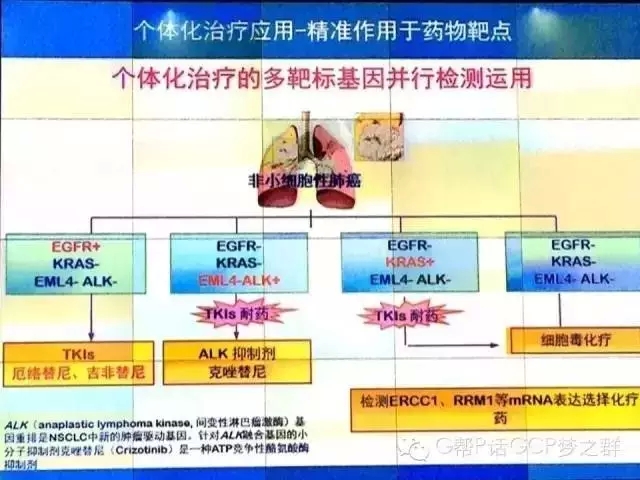
上图所示,当前肺癌分子靶向治疗所确立的标志物检测方法均源自国外研究成果。
3.承担遗传学检测的实验室是否具备检测能力和资质
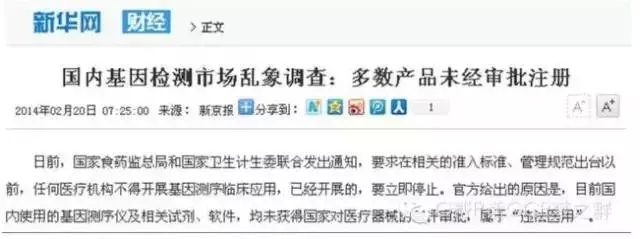
(1)分子靶向治疗带给我国的基因检测乱象
(2)我国现有基因分子检测临床应用的监管体系
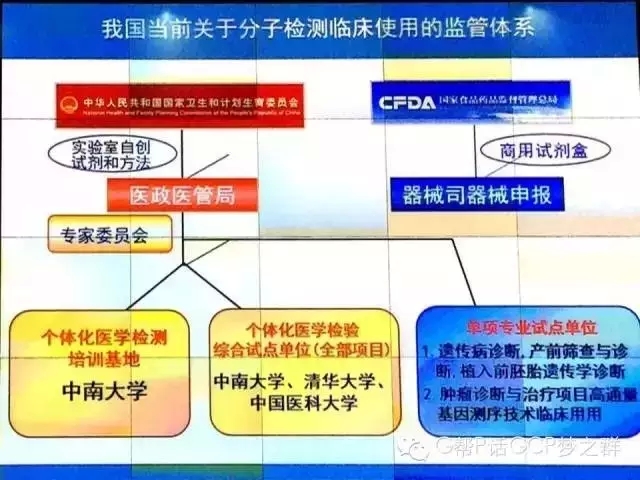
(3)管见:经过认证的高水平中心实验室既要承担基因检测任务,也要参与临床采样阶段的操作流程制定和抽验审核职责。
4.需要专门的样本收集知情同意书,且充分说明了收集样本可能带来的风险、利益和其他可选的参与方案
(1)专门的样本收集、管理和知情同意过程已是国际通行的规则

(2)我国临床试验中样本收集知情同意书的内容有待规范,常见如下词汇:
i.“剩余的组织^”:个体化、精准化治疗时代可能不再有多余的组织,特别是肿瘤病人在后续治疗中随着新靶向药物的不断涌现,对组织标本的需求是无法预估的。
ii.“研究报告可能不会告知你本人^”
应该考虑如何使受试者最大程度受益,而不是简单处理:
☆对于已患有症状但无法明确病因的患者及其家属往往非常希望得到一些与病因有关的信息;
☆获知某些遗传学信息,也可能为他们提供有关家族中再现风险的信息和个人健康预后的预期知识,还可采取进一步的健康管理措施;
☆为使受试者获得最大程度的受益,还应让受试者享有在必要时查询检查结果的权利(不主动告知,但接受查询)
iii.“最大的风险就是泄漏你的健康信息^”
应该更多提示一些遗传学研究特有的风险,而不只是信息保密这么简单:
☆对家族的影响
■可能会在无意间发现意外的亲属关系,比如弄错的双亲
■如患者同意但亲属不知情,检测结果可能使亲属感觉错愕
■有些家庭成员可能会把疾病危险因素归咎于他们的长辈
■有些家庭成员可能会因为自身的遗传性状而产生心理压力
☆遗传学检测的误差
■遗传学检测的结果表面上是貌似铁定的客观结果,实际上其临床相关性并非那么肯定
■基因分型可能会弄错,尤其是那些未按临床试验标准建立的实验室(我们在多个试验中发现不同实验室检测同一基因结果不一致的情况)
■有些基因突变可能不是致病的,但被错误的用于疾病预测
■没有找到突变也不等于排除了特定疾病
■对于多种族国家,一些基因检测可能会给受检者烙上“种族烙印”
☆应该让更多的人意识到,缺乏涉及基于遗传学检测结果导致的就业、保险等社会歧视的相关法律,就无法有效控制风险
☆对于肿瘤等危及生命的重大疾病,对病人“保密”还是“必要的透露”才能避免“最大的风险”?
5.收集样本后是否出具检测报告?如果出具检测报告是否能作为临床决策的依据?如果不打算出具检测报告将如何公示样本和遗传学信息的使用与管理情况?
(1)目前只有分子靶向药物临床应用中对受试者治疗靶点的检测会报告结果
(2)不报告结果的原因大体为:
●尚未确定检测什么基因
●研究只是初步的,不能给临床作为参考
●研究结果保密原因
(3)不公开研究计划和研究结果的弊端
●受试者的知情权受到挑战
●各种临床试验纷纷要求获取标本,导致组织标本的重复采集
●由于各自的研究计划不公开,存在重复开展小规模、低统计效率研究的风险
6.如何改进临床研究附带遗传学研究的现状?(鸟无头不飞_修法!)
(1)防范“种族烙印”风险已上升到国家安全的高度,应引起研究者的重视
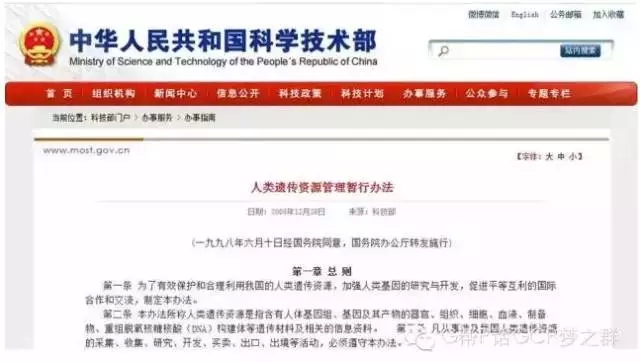
这部法规内容主要围绕如何有效遏制我国人类遗传资源流失现象,保护我国的人类遗传资源。
(2)摘自“关于起草<人类遗传资源管理条例(送审稿)>的说明”的一段话
近年来,国外一些机构和企业对我国人类遗传资源的非法收集和攫取行为仍时有发生。对人类遗传资源的攫取形式也由自行收集,扩大为通过与国内机构或专家合作,由国内机构或专家收集后输出境外;出境途径也由携带基因样本出境转变为通过互联网将基因数据发往国外,手段更为隐秘。因此,有必要通过完善法律,进一步加强对我国人类遗传资源的保护和利用。
(3)我国虽颁布了相关规定,但条款规定比较宽泛,缺乏具有可操作性的指导原则或操作指南,导致推行力度不足
●1998年6月,国务院制定<人类遗传资源管理暂行办法>。
●2005年12月,科技部官网转发了国务院1998年6月制定的<人类遗传资源管理暂行办法>,如上图。
●2007年1月,卫生部颁布<涉及人的生物医学伦理审查办法(试行)>

●2012年10月,国务院<人类遗传资源管理条例(送审稿)>公开征求意见。该文件试图对98年版的<人类遗传资源管理暂行办法>进行细化:
☆实行收集保藏单位的资质审批制度。
☆加强对收集、保藏和研究利用行为的规范。
☆加强对收集、保藏和研究利用行为的监督。
☆进一步明确国际合作中的国家利益。
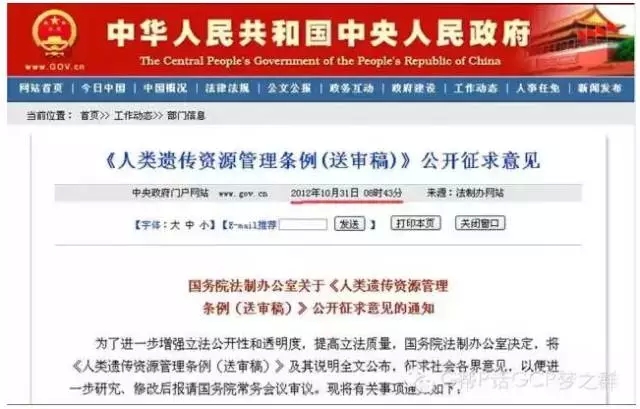
●2014年2月,新浪网报道“人类遗传管理条例正在起草…”?
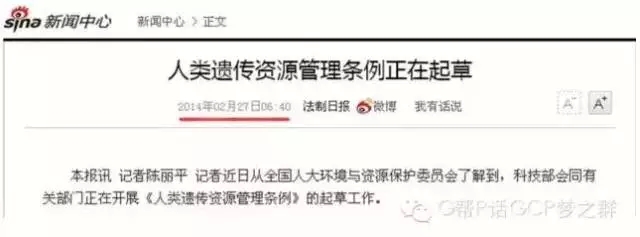
●2014年7月,科技部生发中心发出“关于实施<人类遗传资源管理暂行办法>有关问题的通知”,表明目前我国仍在施行1998年的管理办法!
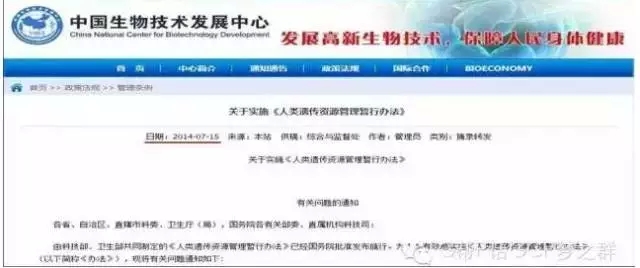
●新法值得期待,<人类遗传资源管理条例(送审稿)>已经凝结了很多专家学者的智慧,虽未正式颁布,也可以从中学到很多东西。
7.小结
首次尝试以微信方式与大家交流,受时间限制,很多问题和思考也无法一一展开。
(1) 这个议题以往讨论得比较少,本人的观点不一定全面、正确;
(2)只是希望抛砖引玉,引起大家对这个议题的关注和思考;
(3)在大家的共同努力下最终提升我国临床试验附带遗传学研究问题上的认识水平和操控水平。
摘自:G帮P话GCP梦之群
======联系我们=========
天之力医药(微信号:bjtianzhili)专注于医药产品力提升。
回复数字“2”可查看历史推送文章。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx