药物研发领域的“资产流转”再添新的经典案例。
9月9日,诺华宣布已与临床阶段的生物制药公司Tourmaline Bio达成一项收购协议,将以每股48美元的价格收购后者,总交易额约为14亿美元,预计在2025年第四季度完成。据悉,Tourmaline Bio唯一的核心资产Pacibekitug(TOUR006)是一款临床在研长效抗IL-6单抗,正在开发作为动脉粥样硬化性心血管疾病(ASCVD)的新治疗选择。

炎症是心血管疾病的主要驱动因素,但目前尚无广泛采用的抗炎疗法可用于降低心血管风险。而TOUR006靶向的IL-6是一种促进全身炎症的关键上游细胞因子,将解决未被满足的临床需求。诺华认为,TOUR006的Ⅱ期临床进展顺利,通过并购获得该Ⅲ期临床就绪资产,将补充其现有的心血管疾病产品组合。
值得一提的是,TOUR006最早由辉瑞研发(研发代号PF-04236921),后被视为超出需要的多余项目资产,被出售给Tourmaline Bio。然而,与辉瑞的研发思路相异,Tourmaline Bio使TOUR006走上了治疗炎症疾病的不同路径,最终被诺华收购。
强化心血管核心战略
Tourmaline Bio成立于2021年,其创始人兼CEO Sandeep Kulkarni曾任投资机构KVP Capital的董事总经理,亦曾担任Immunovant、Roivant等多家纳斯达克上市企业高管。2023年6月,Tourmaline Bio宣布与老牌细胞疗法上市公司Talaris Therapeutics达成合并协议,借壳登陆纳斯达克。
Tourmaline Bio目前唯一的管线便是诺华这次收购的核心目标TOUR006。TOUR006和BMS的O药皆由Medarex的转基因小鼠平台生成,最早由辉瑞进行开发,彼时的研发代号为PF-04236921。2010—2016年,辉瑞在克罗恩病、红斑狼疮和类风湿性关节炎患者中开展TOUR006的早期临床试验,这一开发重心与赛诺菲/再生元、罗氏等其他IL-6靶向药物开发商基本重合。
但罗氏的托珠单抗、赛诺菲/再生元的Sarilumab分别在2010年、2017年相继获得FDA批准,彼时尚处于早期临床的TOUR006并不具备明显的竞争优势,以至于被辉瑞一度视为超出需要的多余项目资产。2022年5月,瞄准机会的Tourmaline Bio与辉瑞达成协议,获得TOUR006的全球独家开发和商业化权利。
Tourmaline Bio认为,在炎症疾病和自免疾病中,IL-6通路抑制剂展现出令人信服的临床获益信号,但尚未得到充分开发。于是,Tourmaline Bio为TOUR006制定了多个方面的临床开发计划,包括动脉粥样硬化性心血管疾病(ASCVD)、甲状腺眼病(TED)以及腹主动脉瘤(AAA)。
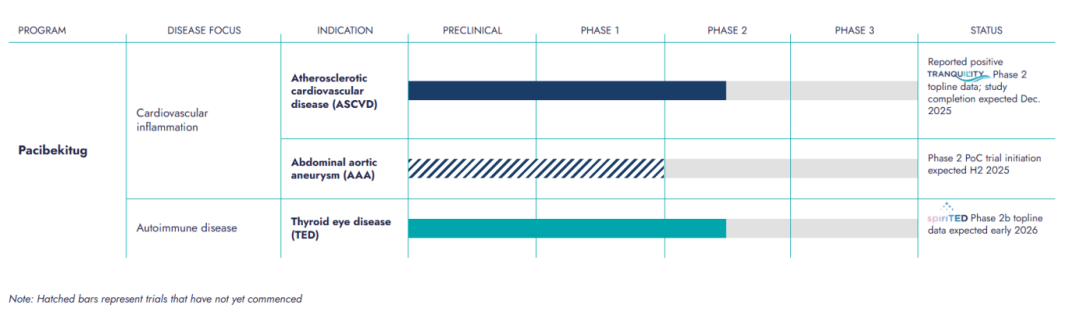
今年5月,Tourmaline Bio公布了TOUR006的Ⅱ期临床TRANQUILITY研究首批结果。该试验评估了高敏C反应蛋白(hs-crp)升高的患者每季度和每月皮下注射TOUR006,与心血管风险升高和慢性肾脏疾病(CKD)相关的生物标志物。
结果显示,最高剂量的TOUR006在90天内使患者的炎症指标高敏C反应蛋白(hs-CRP)水平降低了86%,而接受安慰剂治疗的受试者的hs-CRP水平仅降低了15%。该研究结果证明,TOUR006可大幅减少通常与心脏病相关的炎症程度,支持其在ASCVD和其他心血管疾病患者中开展后期试验。

押宝TOUR006的背后,是诺华对其心血管疾病管线战略布局的深思熟虑。心血管-肾脏-代谢管线对诺华的贡献仅次于肿瘤学,今年上半年为诺华创造了51.73亿美元收入,同比增长26%。其中,兼具降压和抗心力衰竭作用的重磅药物沙库巴曲缬沙坦(诺欣妥)仍是诺华的支柱产品,46.18亿美元销售额和同比22%的强劲增长令其继续霸榜诺华全球最畅销产品。
但诺欣妥正在迎来更多竞争对手。尽管诺欣妥在第十一批国采中因存在专利侵权高风险而被豁免纳入,但已有南京一心和、科伦药业两家国内企业的同品种药物突破专利壁垒上市。不仅如此,诺欣妥在美国市场的独占期也正在受到来自MSN制药、瑞迪博士等公司的多款仿制药挑战。
这笔收购是在诺华强化心血管核心治疗领域的战略背景下诞生的,其看中了TOUR006这款药物在解决心血管残余炎症风险这一巨大未满足医疗需求方面的独特价值。这是一个典型的“引进创新”策略,通过收购具有高度协同性和市场前景的晚期资产,来快速巩固和扩展自己在关键领域的领导地位。
同时,Tourmaline Bio也在探索TOUR006用于TED等其他适应症。诺华收购Tourmaline Bio后,可能也会评估这些机会,进一步挖掘该药物的价值。
疗效仍需明确证实
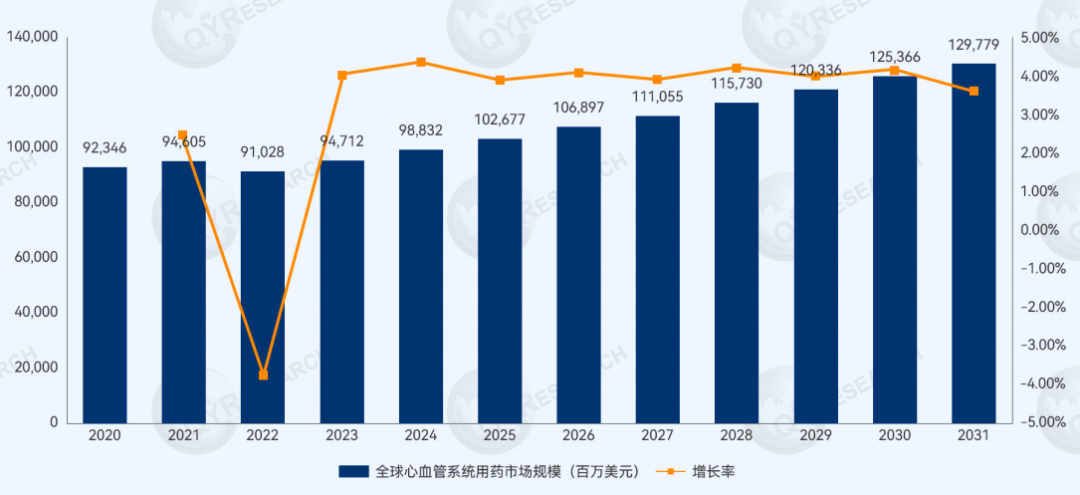
在全球慢性病发病率持续攀升的背景下,心血管系统用药作为预防和治疗心脏及血管相关疾病的关键药物类别,市场需求保持稳定增长。根据QYResearch调研数据,2024年全球心血管系统用药销售额已达988亿美元,预计2031年将增长至1298亿美元,展现出该领域的持续发展潜力。
截至目前,全球已有多款靶向IL-6或IL-6R的药物获批上市,包括罗氏的托珠单抗、赛诺菲/再生元的Sarilumab、强生的司妥昔单抗和罗氏/Chugai的萨特利珠单抗等,但仍未有产品拿下治疗心血管疾病的适应症。除了这次被诺华收购的TOUR006,诺和诺德的Ziltivekimab同样值得关注。
Ziltivekimab最初是由Corvidia Therapeutics研发的IL-6单抗药物,旨在通过抑制IL6降低全身炎症。凭借延长半衰期的技术,Ziltivekimab为每月皮下注射一次。2020年6月,诺和诺德宣布收购Corvidia Therapeutics,将Ziltivekimab收入囊中。根据协议,诺和诺德将支付给Corvidia Therapeutics7.25亿美元前期付款,总交易额最高可达到21亿美元。

Ⅱ期研究数据显示,与安慰剂相比,Ziltivekimab可使hs-CRP水平降低约90%。目前,Ziltivekimab在研适应症为ASCVD伴CKD、急性心肌梗死(AMI)和心力衰竭(HFpEF),相关试验均已推进至Ⅲ期临床。
不仅如此,CSL Behring申报的clazakizumab也在2024年于国内获批临床,拟开发用于降低接受维持性透析的成人患者的心血管死亡和心肌梗死风险,这些患者具有系统性炎症证据并且患有动脉粥样硬化性心血管疾病或糖尿病。公开资料显示,clazakizumab是一种靶向IL-6配体的单抗,其治疗慢性活动性抗体介导的排斥反应(AMR)的适应症开发在国际范围内处于Ⅲ期临床阶段。
抗IL-6单抗在心血管疾病领域的研发特别是针对ASCVD,是当前的热门方向。这背后的核心思路为:炎症是心血管疾病的一个重要独立风险因素,仅仅控制胆固醇等传统因素可能还不够。
虽然前景可观,但抗IL-6单抗在心血管领域的开发也面临多个关键挑战,例如疗效还需明确证实,Ⅱ期研究主要观察的是hs-CRP等生物标志物的改善。然而,药品监管机构批准药物用于心血管领域,通常需要大规模Ⅲ期研究证实,其能显著降低主要不良心血管事件(MACE),如心脏病发作、卒中或心血管死亡的发生率,这是抗IL-6药物需要最终跨越的“金标准”。
此外,IL-6通路在免疫防御中也有作用,长期抑制IL-6可能需要密切关注感染风险,如严重感染、机会性感染等,以及对血脂水平和肝功能的潜在影响。目前,相关在研的Ⅱ期数据表明安全性尚可,但大规模长期试验的数据至关重要。
尽管诺和诺德的Ziltivekimab和诺华刚刚收购的TOUR006处于领先地位,但Ⅲ期临床的结果才是真正的“试金石”。未来几年,随着这些大型临床试验数据的读出,业界将更清楚地了解这类药物在心血管疾病防控中的确切价值。如果成功,这不仅是新药的诞生,更意味着心血管疾病治疗理念的一次重要演进。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx