近日,国家药监局药品审评中心网站更新了1条常见一般性技术问题并给出解答。
Q
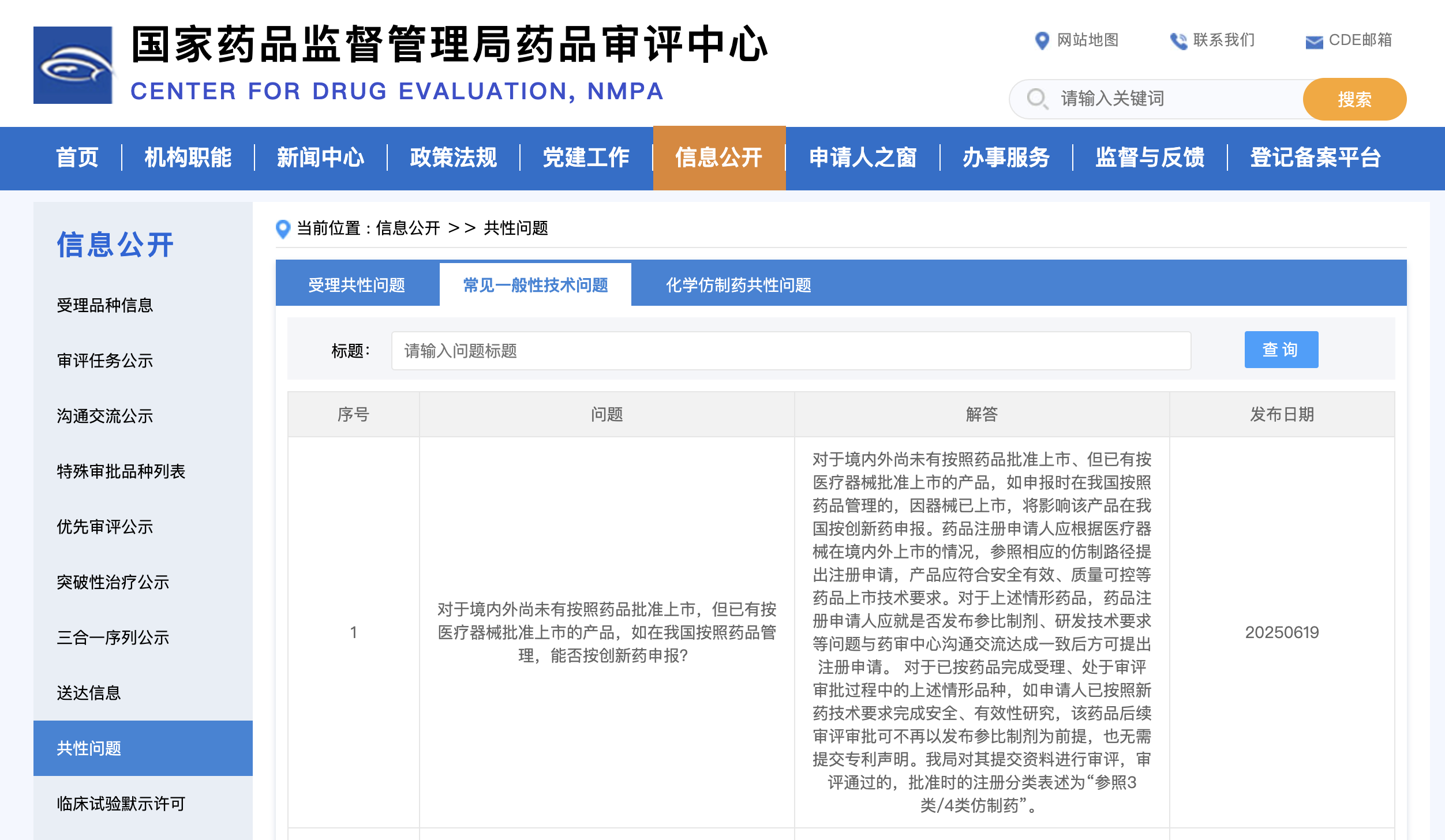
对于境内外尚未有按照药品批准上市,但已有按医疗器械批准上市的产品,如在我国按照药品管理,能否按创新药申报?
对于境内外尚未有按照药品批准上市、但已有按医疗器械批准上市的产品,如申报时在我国按照药品管理的,因器械已上市,将影响该产品在我国按创新药申报。药品注册申请人应根据医疗器械在境内外上市的情况,参照相应的仿制路径提出注册申请,产品应符合安全有效、质量可控等药品上市技术要求。对于上述情形药品,药品注册申请人应就是否发布参比制剂、研发技术要求等问题与药审中心沟通交流达成一致后方可提出注册申请。 对于已按药品完成受理、处于审评审批过程中的上述情形品种,如申请人已按照新药技术要求完成安全、有效性研究,该药品后续审评审批可不再以发布参比制剂为前提,也无需提交专利声明。我局对其提交资料进行审评,审评通过的,批准时的注册分类表述为“参照3类/4类仿制药”。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx