4 月 28 日,CDE 官网显示,诺华在国内递交了一项镥 [177Lu] 特昔维匹肽注射液的新适应症上市申请(受理号:JXHS2500054)。根据该药研究进度推测,本次申报的适应症可能为:PSMA 阳性去势抵抗性前列腺癌的二线治疗。
 截图来自:CDE 官网
截图来自:CDE 官网Pluvicto(镥 [177Lu]-特昔维匹肽)是通过静脉注射的放射配体疗法(RLT),由靶向配体与治疗性放射性核素(镥-177)结合而成。进入血液后,Pluvicto 可靶向结合表达前列腺特异性膜抗原(PSMA)的前列腺癌细胞。结合后,放射性同位素释放的能量可破坏靶细胞,抑制其复制能力和/或引发肿瘤细胞死亡。
在海外,Pluvicto 于 2022 年先后获得美国 FDA 和欧洲 EMA 批准,用于 PSMA 阳性去势抵抗性前列腺三线治疗。2025 年 3 月,FDA 又批准了该药的拓展适应症,用于在一种雄激素受体通路抑制剂(ARPI)治疗后、未经过化疗的 mCRPC 患者,即二线治疗。
在国内,Pluvicto 在 2024 年 9 月递交了首个上市申请(受理号:JXHS2400095),并被纳入优先审评,适用于治疗 PSMA 阳性转移性去势抵抗性前列腺癌(mCRPC) 、已接受雄激素受体通路抑制和紫杉类化疗的成年患者,即三线治疗。
诺华目前还正在国内开展一项开放标签、多中心、随机、II 期研究(CTR20230581),旨在未曾接受过紫杉烷类药物的进展性 mCRPC 中国男性患者中(二线治疗),评估 Pluvicto 相比更换另一种雄激素受体定向治疗在延长 rPFS 方面的有效性。该研究主要指标已于 2024 年 12 月完成。
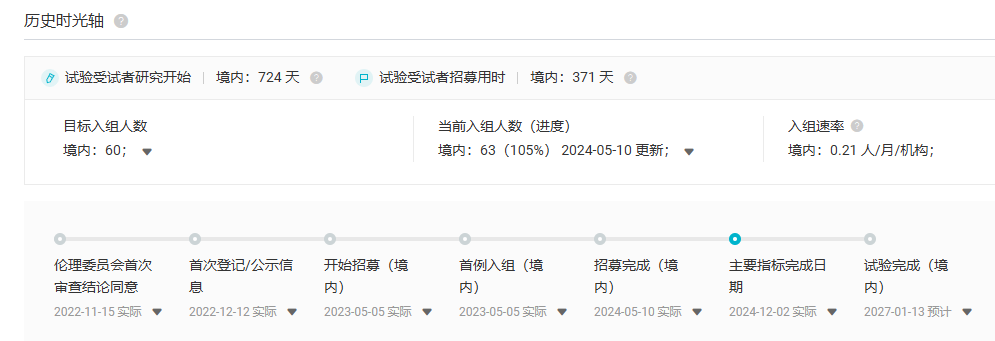 来源:Insight 数据库
来源:Insight 数据库FDA 对 Pluvicto 的二线适应症的批准是基于 III 期 PSMAfore 临床研究的结果,该研究将符合 Pluvicto 治疗条件的患者人群扩大约三倍。研究结果显示,与更换 ARPI 方案相比,Pluvicto 将 PSMA 阳性 mCRPC 患者的影像学进展或死亡风险降低 59%(HR=0.41;95%CI:0.29-0.56;p<0.0001)。在更新的探索性分析中,Pluvicto 组的中位影像学无进展生存期延长了一倍以上(11.6 个月 vs. 5.6 个月)。
PSMAfore 研究的其他结果显示,Pluvicto 表现出一致的、更好的安全性特征。最常见的所有级别的不良事件主要为 1-2 级,包括口干、疲劳、恶心和便秘。Pluvicto 不影响患者后续接受化疗的能力。
Pluvicto 是诺华核药领域的重磅产品。该药于 2022 年全球首批。2024 年,其销售额实现了 42% 的增长,首次突破十亿美元大关,达到 13.92 亿美元,成为诺华旗下又一款重磅炸弹。随着新适应症的拓展,Pluvicto 未来有望加速放量。
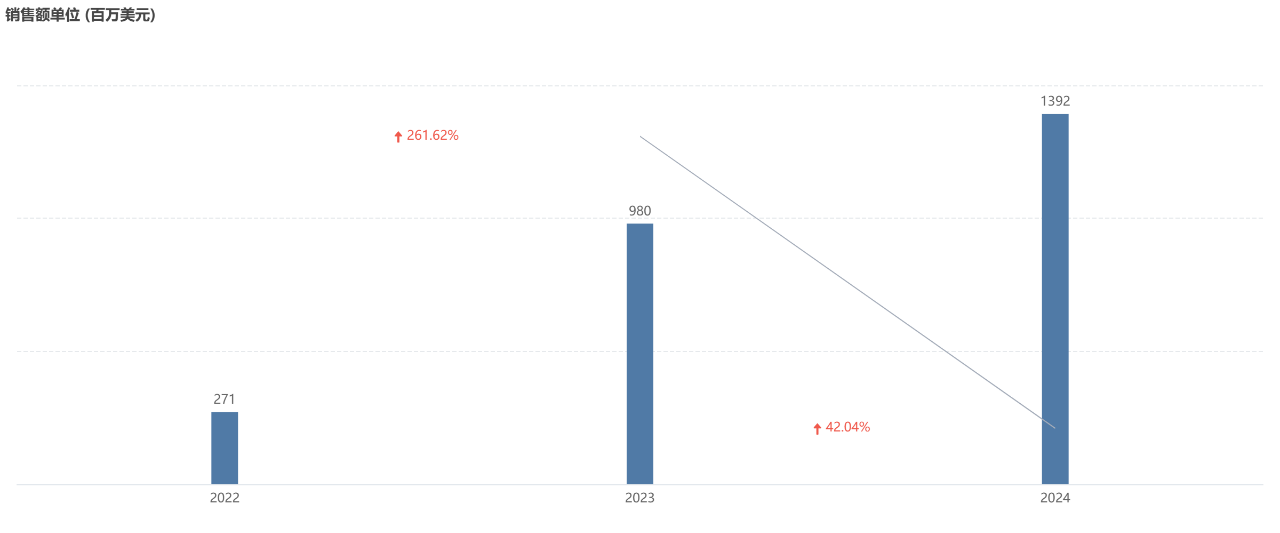
来源:Insight 数据库
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx