4月7日,华东医药发布公告,其控股子公司道尔生物申报的注射用 DR30206 临床试验申请获得批准,联合标准化疗,拟用于晚期或转移性消化道肿瘤患者。

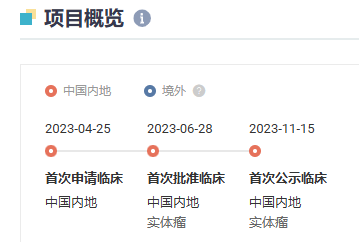
据悉,DR30206 是由道尔生物自主研发并拥有全球知识产权的 1 类治疗用生物制品,为一款靶向 PD-L1、VEGF 和 TGF-β 的抗体融合蛋白。此前,DR30206 于 2023 年 4 月首次在中国申请临床,同年 6 月首次获批临床,适应症为晚期实体瘤,2023 年 11 月首次公示临床。
据统计,目前全球范围内只有 3 款 PD-L1、VEGF 和 TGF-β 三靶点靶向药物在研(仅统计活跃状态),分别来自华东医药、普米斯生物和启愈生物,且均为国产。
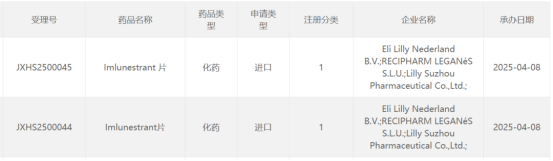
4月8日,CDE官网最新公示,礼来申报的1类新药imlunestrant片上市申请获得受理。公开资料显示,imlunestrant片是礼来在研的口服选择性雌激素受体降解剂(SERD)。该产品治疗雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)晚期乳腺癌患者的3期临床研究此前已取得积极结果。
据悉,Imlunestrant是一款可穿越血脑屏障的小分子SERD药物。它的设计目标是无论ESR1突变状态如何,均能够在整个给药期间持续抑制ER靶点的活性。近年来,针对ER的蛋白降解疗法开始成为重要的乳腺癌治疗模式。
此外,礼来针对在中国开展了两项3期临床研究,包括EMBER-3研究,以及在早期乳腺癌受试者中比较Imlunestrant和标准内分泌治疗的研究(EMBER-4研究)。本次Imlunestrant于中国申报上市,意味着其临床研发进程将迎来新的进展。
4月7日,CDE官网显示,诺华英克司兰钠注射液新适应症上市申请获受理。根据临床进展和公开资料推测该适应症为用于未接受任何降脂治疗的动脉粥样硬化性心血管疾病(ASCVD)中危或低危且低密度脂蛋白胆固醇(LDL-C)升高的成人患者。

此次新适应症的上市申报递交基于此前诺华于2024 年8月宣布的,其一年两针*降脂产品英克司兰钠(在初始治疗后三个月注射加强针,此后每年需注射两次)在 III 期临床 V-MONO 研究中取得积极顶线结果,达到其主要终点。
公开资料显示,英克司兰钠是全球首款也是目前唯一一款降低 LDL-C 的小干扰 RNA 药物,于 2020 年、2021 年分别获欧盟、FDA 批准上市,用于治疗成人高胆固醇血症及混合性血脂异常,证明了小核酸药物在慢病领域的治疗潜力。截至目前,该药已经在包括美国、欧盟以及中国在内的近 100 个国家/地区获得批准,在欧盟获批 4 项适应症,在美国获批 3 项适应症,在中国获批 4 项适应症。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx