跨国药企 2024 年财报披露接近尾声,各家都有不错的业绩亮点。那么 2025 年,制药巨头们又会有哪些重磅里程碑事件为今年业绩贡献新力量?以下是 Insight 数据库根据企业 2024 年财报梳理的 MNC 在 2025 年的重磅催化剂事件(部分),供业内参考。

重症肌无力单抗将首次获批!2 款新药首次报上市
2025 年,强生将迎来创新药管线重要突破,靶向 FcRn 的重磅单抗即将获批,开启新战线,同时达雷妥尤单抗、古塞奇尤单抗等多款核心产品将迎来新适应症,深化免疫与肿瘤领域的布局:
靶向 IL23A 的古塞奇尤单抗(Guselkumab),24 年销售额为 36.7 亿美元(同比+16.6%),2025 年将有 6 个新适应症获批上市,分别为溃疡性结肠炎(皮下诱导)、克罗恩病(皮下诱导)、儿童银屑病、克罗恩病、幼年型银屑病关节炎、溃疡性结肠炎。
还有两款新药首次报上市,剑指银屑病口服疗法空白和抑郁症未被满足的临床需求,进一步巩固在自免与神经科学的布局:
将首次提交口服 KOR 抑制剂 Aticaprant 上市申请(US),用于重度抑郁症。
强生有多项临床数据将集中亮相,从 RPGR 基因疗法挑战遗传性眼病,到埃万妥单抗拓展实体瘤疆域,再有 IL-23R 多肽药物跨界布局肠道炎症:
公布 RPGR 基因疗法关键 III 期临床结果,用于 X 连锁视网膜色素变性;
公布埃万妥单抗用于头颈部鳞状细胞癌、结直肠癌;
公布 IL-23R 口服多肽 Icotrokinra 用于溃疡性结肠炎的 II 期临床结果。

截图来源:强生财报

诺华
IgA 肾病新药将首次获批,重磅核药再添新适应症
诺华 2025 年管线火力全开,IgA 肾病新星即将全球首批,多款拳头产品同步拓宽适应症疆界:
IgA 肾病新药 Atrasentan(阿曲生坦)将迎来首次批准上市(FDA),这是诺华以 35 亿美元收购 Chinook 公司获得的一款 ETA 拮抗剂,目前该药也已在中国报上市;
核药 Pluvicto 新适应症将获 FDA 批准上市,用于未接受过紫杉类化疗的 PSMA 阳性转移性去势抵抗性前列腺癌(mCRPC) 患者。该药最早于 2022 年获批,2024 年收入达 13.92 亿美元,同比增长 42%;
口服 BTK 抑制剂 Remibrutinib(瑞米布替尼)将在美国、欧盟、中国(中国已递交)首次递交上市申请,用于慢性自发性荨麻疹(CSU),是诺华在自免领域又一重磅产品;
重磅核药 Pluvicto 将在 FDA 递交新适应症上市申请,用于转移性激素敏感性前列腺癌(mHSPC);
司库奇尤单抗用于 GCA 和风湿性多肌痛(PMR)的关键 III 期临床结果将读出;
靶向 BAFFR 的单抗 Ianalumab 两项关键 III 期临床结果读出,分别用于干燥综合征(SjS)和二线免疫性血小板减少症(ITP);

截图来源:诺华财报

辉瑞
迎来 4 项注册申请,读出 9 个 III 期结果
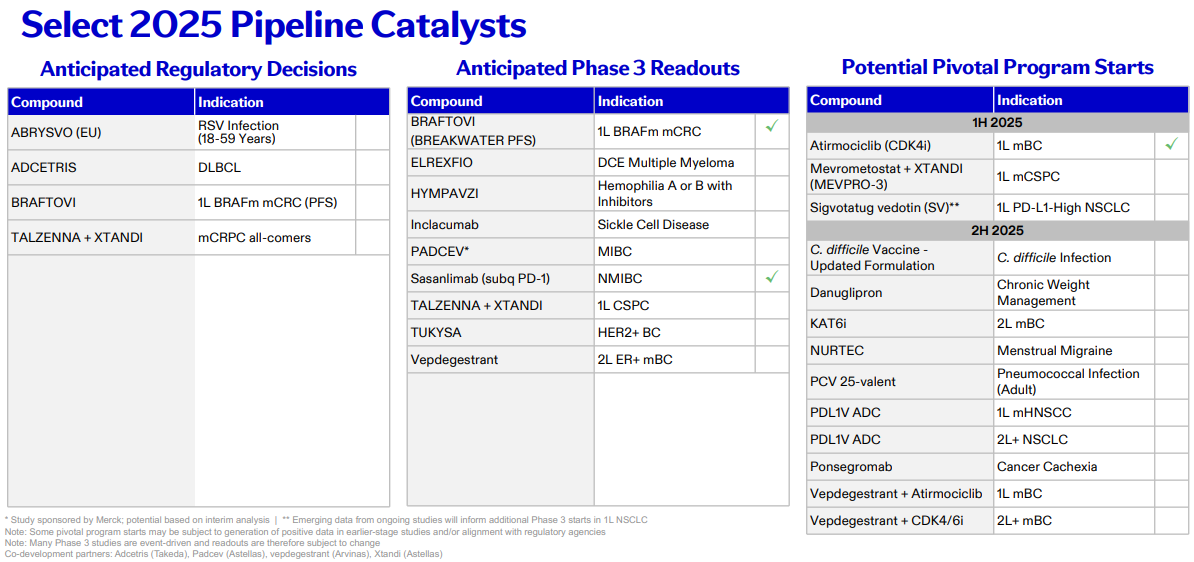
2025 年,辉瑞公司预计将有 4 项注册批准,涉及 RSV 疫苗 Abrysvo、维布妥昔单抗、拉唑帕利和恩扎卢胺联合疗法等:
RSV 疫苗 Abrysvo 将在欧洲获批用于 18-59 岁成人呼吸道合胞病毒感染。该疫苗此前已获批用于 60 岁及以上人群,2024 年全球销售额 7.55 亿美元(同比 -15%),随着适用人群的拓展,未来销售额有望提升;
靶向 CD30 的 ADC 维布妥昔单抗(Adcetris)将在美国获批新适应症,用于弥漫性大 B 细胞淋巴瘤(DLBCL),该药 2024 年营收达 10.89 亿美元;
首次公布 SELP 单抗 Lnclacumab 用于镰状细胞病的关键 III 期临床结果;
公布 ER PROTAC 药物 Vepdegestrant 二线治疗 ER 阳性乳腺癌的关键 III 期临床结果;
BCMA/CD3 双抗 Elranatamab,将公布一项关于多发性骨髓瘤的 III 期临床结果;
除此之外,还有多项潜在关键项目启动,包括肿瘤领域 Atirmociclib(CDK4 抑制剂)、Sigvotatug vedotin(ITGB6 ADC),代谢领域 Danuglipron(GLP1R 激动剂)、Ponsegromab(GDF15 单抗)等。
 截图来源:辉瑞财报
截图来源:辉瑞财报

阿斯利康
10 个重磅产品迎来监管决定
2025 年,阿斯利康多款成熟产品将通过适应症外延与联合方案再掀增长浪潮,包括度伐利尤单抗、阿可替尼,还有 TROP2 ADC 德达博妥单抗抢滩 EGFR 突变非小细胞肺癌后线治疗,叠加司美替尼向成人患者群体扩容:
度伐利尤单(Imfinzi)抗将迎来新适应症获批,联合化疗用于肌层浸润性膀胱癌,有望成为该治愈性治疗中首个也是唯一一个围手术期免疫治疗方案。该适应症已于 2024 年 12 月在美国报上市并获得优先审评,FDA 预计 2025 年 Q2 做出监管决定;
第二代 BTK 抑制剂阿可替尼(Calquence)加维奈克拉联合或不联合奥妥珠单抗将在美国获批一线 CLL 固定疗程治疗,届时阿可替尼将成为唯一可作为治疗进展和固定疗程治疗的第二代 BTK 抑制剂;
TROP2 ADC 德达博妥单抗(Datroway)将在美国获批用于 EGFR 突变非小细胞肺癌后线治疗,2024 年 11 月已经在 FDA 报上市,肺癌适应症的获批对于 TROP2 ADC 的竞争格至关重要;
7 项 III 期数据蓄势待发,PTHR1 激动剂挑战甲状旁腺功能减退症,新一代 SERD 刷新乳腺癌一线治疗方案,ATR 抑制剂强攻 PD-1 耐药后 NSCLC,高血压与罕见病领域创新疗法登场:
Camizestrant 是新一代口服 SERD,将首次公布联用 CDK4/6 抑制剂一线治疗晚期 HR 阳性乳腺癌伴 ESR1 肿瘤突变患者的关键 III 期结果 (SERENA-6)。有媒体预测,Cagrisema 净现值将达到 45 亿美元;
Anselamimab 是一种嵌合 IgG1κ抗体,将首次公布用于 AL 型淀粉样变性的关键 III 期结果(CAEL101-302/ CAEL101-301),目前该适应症已获 FDA 快速通道资格,预计 2025 年报上市;
Gefurulimab 第三代 C5 抑制剂,将首次公布用于重症肌无力的关键 III 期结果 (ALXN1720-MG-301),有望成为可居家用药的每周 1 次皮下注射疗法;
Eneboparatide 是收购 Amolyt Pharma 获得的一种 PTHR1 激动剂,将首次公布用于治疗甲状旁腺功能减退症的关键 III 期 CALYPSO 研究结果;
Ceralasertib 是一种口服 ATR 激酶抑制剂,将首次公布联合度伐利尤单抗和化疗用于 PD-1/L1 耐药后 NSCLC 的 III 期临床结果 (LATIFY);
Baxdrostat 是一种用于治疗高血压的高度选择性醛固酮合成酶抑制剂(ASI),将首次公布关键 III BaxHTN 研究结果;

截图来源:阿斯利康财报

礼来
礼来 2025 年迎来创新药爆发期,全球首个口服 SERD 药物 Imlunestrant 将迎来全球首批,替尔泊肽从减重领域攻入心衰战场,深化布局肿瘤与代谢疾病领域的治疗版图:
口服 ER 降解剂(SERD)Imlunestrant 将在美国和日本获得批准,用于 ER+/HER2- 转移性乳腺癌,这将是该药物的全球首获;
明星产品替尔泊肽(Tirzepatide)用于射血分数保留的心力衰竭(HFpEF)将在美国和欧盟获批。2024 年,替尔泊肽收入狂飙,贡献 164.6 亿美金,占礼来 2024 年总营收近三分之一;
匹妥布替尼(Pirtobrutinib)是 FDA 批准的首个可逆 BTK 抑制剂,2025 年有望在美国、欧盟获得 CLL 的完全批准许可(注:在财报中还有日本,但在企业发布的获批上市公告以及 PMDA 的审查书中未找到附条件批准的信息);
米吉珠单抗(Mirikizumab)是一款人源化 IgG4 抗体,选择性靶向 IL-23 的 p19 亚基并抑制 IL-23 途径,2025 年将于欧盟和日本获批用于克罗恩病;
多奈单抗有望在欧盟获批用于早期阿尔茨海默病。
除了匹妥布替尼和替尔泊肽新适应症即将报上市以外,礼来还有 2 款新药将首次向监管机构提交上市申请:
Insulin efsitora alfa(LY3209590)是一种每周一次的胰岛素融合蛋白,结合了胰岛素的新型单链变体和人 IgG2 Fc 结构域,该药物预计于 2025 年首次提交用于治疗 2 型糖尿病的上市申请;
2025 年,礼来将首次公布 6 项关键 III 期临床数据,这些数据来自口服 GLP-1R 激动剂 Orforglipron、替尔泊肽、匹妥布替尼、瑞他鲁肽:
首次公布口服 GLP-1R 激动剂 Orforglipron 用于肥胖以及用于 2 型糖尿病的关键 III 期临床结果;
首次公布替尔泊肽用于糖尿病患者的心血管事件二级预防的关键 III 期临床结果;
首次公布在未经治疗的 CLL 患者中比较匹妥布替尼与苯达莫司汀联合利妥昔单抗,以及在 CLL 患者中比较匹妥布替尼与伊布替尼的关键 III 期临床结果;
 截图来源:礼来财报
截图来源:礼来财报

罗氏
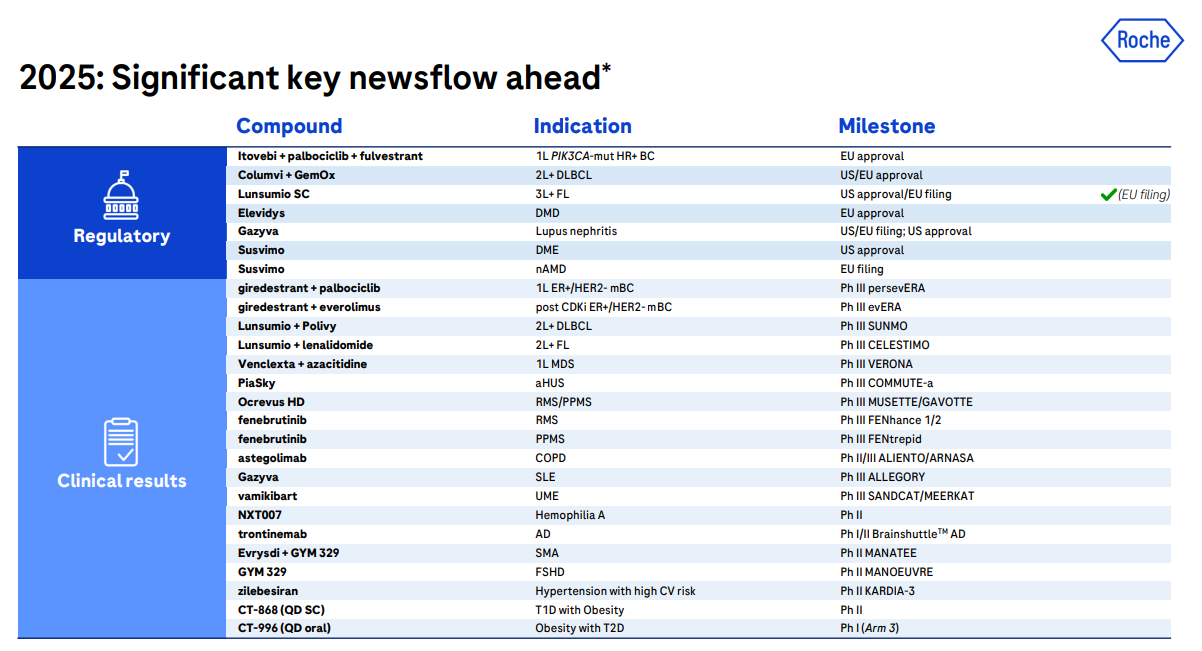
将首次公布多个重磅新药关键 III 期结果2025 年,罗氏总共将迎来 7 个适应症的监管批准,涉及肿瘤、自免等领域,其中涉及三款抗体药物:
CD3/CD20 双抗格罗菲妥单抗(Columvi)新疗法预计今年在美国、欧盟获批,联合吉西他滨、奥沙利铂治疗二线及以上复发/难治性用于弥漫大 B 细胞淋巴瘤;该药最早 23 年 6 月获批上市,24 年全球销售额 1.95 亿美元。
CD3/CD20 双抗莫妥珠单抗(Lunsumio)将首次获批皮下注射剂型(美国),治疗既往接受过至少二线系统性治疗的复发或难治性滤泡性淋巴瘤成人患者。
多款新药将揭盲 III 期临床结果,其中有 4 款新药为首次重磅揭晓,分别是新一代 ER 降解剂、IL1RL1 单抗、IL-6 单抗和 BTK 抑制剂:
首次公布新一代口服 ER 降解剂 Giredestrant 的两项关键 III 期临床结果,包括Giredestrant 联合依维莫司对比内分泌疗法联合依维莫司,以及Giredestrant 联合哌柏西利对比来曲唑联合哌柏西利治疗ER+/HER2-局部晚期或转移性乳腺癌患者;
首次公布 IL1RL1 单抗 Astegolimab 用于慢性阻塞性肺疾病的关键 III 期临床结果;
首次公布 IL-6 单抗 Vamikibart 用于葡萄膜炎性黄斑水肿的关键 III 期临床结果;
截图来源:罗氏财报
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx