作为全球首个精准靶向治疗罕见病脊髓性肌萎缩症(SMA)的药物,诺西那生钠注射液自其诞生以来便备受关注,如今其国内首仿之争已然打响。
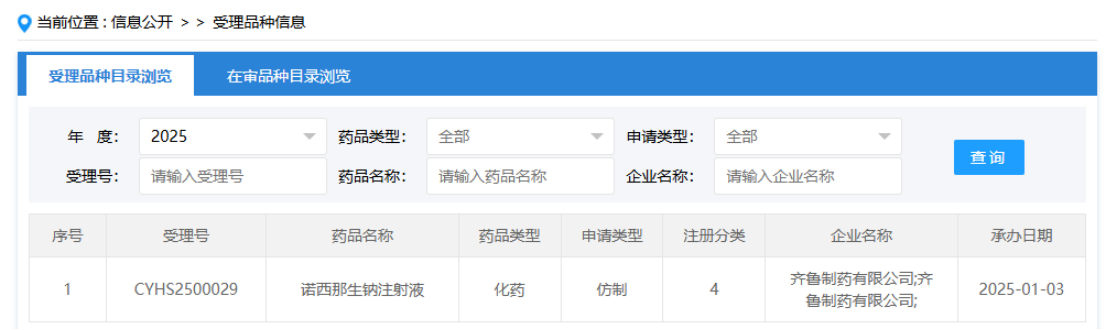
近日,国家药监局药品审评中心(CDE)公开的信息显示,齐鲁制药以仿制4类提交的诺西那生钠注射液的上市申请已获得受理。公开资料显示,2024年9月,重庆药友制药率先递交了诺西那生钠注射液仿制药的上市申请。如今齐鲁制药的加入,使得这一领域的竞争更加激烈。
通过鞘内注射给药,诺西那生钠注射液能够直接将药物输送到脊髓周围的脑脊液中,从而有效改善患者的运动功能、提高生存率,改变SMA的疾病进程。该药的全球首创性和在SMA治疗领域的显著疗效,无疑为罕见病患者带来了新的希望和曙光。
业内人士指出,重庆药友和齐鲁制药相继报产,不仅将促进国内药企在SMA治疗药物研发方面的创新,还有望通过市场竞争降低药物价格,使更多SMA患者能够承担得起治疗费用。随着更多药企的加入和医保政策的持续支持,相信未来SMA患者将拥有更多治疗选择。
2030年专利到期
首仿之争正式打响
脊髓性肌萎缩症(SMA)是一种遗传性的神经肌肉病,其发病机制与两个高度同源的基因——SMN1(运动神经元存活基因1)和SMN2密切相关。这两个基因位于人5号染色体长臂的13.2区域,在人体内发挥着至关重要的作用。SMN蛋白对维持神经元的健康和正常功能不可或缺,而人体所需的SMN蛋白中,85%-90%来自SMN1基因的表达,仅10%-15%来自SMN2基因。
当SMN1基因突变导致个体的SMN蛋白水平不足时,脊髓中的运动神经元可能会丧失,从而表现出肌无力和肌萎缩等临床症状。因此,所有SMA患者都缺乏功能正常的SMN1基因,只能依赖SMN2基因来表达SMN蛋白。值得注意的是,SMN2基因的拷贝数与SMA的严重程度常呈负相关。根据这一机制,SMA可被分为5个表型,从最严重的0型(SMN2拷贝数为1,患者常于1岁内死亡)到较轻的Ⅳ型(SMN2拷贝数为4~8,30岁后发病,患者能独坐和独立行走,且无消化系统和呼吸系统症状)。
自SMN1和SMN2基因被发现以来,众多药企纷纷以此为靶点,投身于SMA领域的药物研发。2016年12月,由渤健自Ionis Pharmaceuticals引进的诺西那生钠注射液(Nusinersen Sodium,商品名Spinraza)获美国食品药品监督管理局(FDA)批准上市,成为全球首个SMA的精准靶向治疗药物。
作为一种18聚体的反义寡核苷酸(ASO),诺西那生钠注射液的独特魅力在于能改变SMN2前mRNA的剪接方式,从而增加完整长度SMN蛋白的产生。该药物通过鞘内注射直接输送至脊髓周围的脑脊液中,发挥治疗作用。由于作用位点精准、特异性高,诺西那生钠注射液还减少了由于脱靶效应产生的不良事件。
在Ⅲ期临床试验ENDEAR研究中,诺西那生钠显著提高了1型SMA患者的无事件生存率及总生存率,长期治疗更使患者的运动功能得到明显改善,部分1型患者甚至达到了运动里程碑。更令人欣喜的是,早期基因诊断后的症状前治疗显示,诺西那生钠有望使即将发展为1型或2型SMA的患儿达到与正常儿童相似的运动发育水平。
近年来,为了提高罕见病诊疗水平,维护罕见病患者健康权益,国家相关部门一直在努力推动SMA治疗药物的研发和上市。2018年,SMA被纳入中国《第一批罕见病目录》,诺西那生钠也作为全球首个SMA的精准靶向治疗药物,被纳入《第一批临床急需境外新药名单》。
2019年2月,诺西那生钠在中国成功获批上市,填补了国内SMA治疗领域的空白。然而,上市之初该药每针近70万元的价格,让绝大多数SMA患者家庭望而却步。幸运的是,2021年经过国家医保谈判的“灵魂砍价”,诺西那生钠注射液成功进入国家医保目录,价格降至每针约3.3万元,大大减轻了患者的经济负担。
根据财报,渤健的诺西那生钠全球销售额在2019-2020年均超过20亿美元,2023年仍达到17亿美元。在中国市场,诺西那生钠注射液的降价和纳入医保极大地提高了其用药患者总量。有数据显示,2022年1月至5月,诺西那生钠注射液的用药患者总量较进医保前翻了五番,药品销售总额也接近其在国内上市两年多的销量总额。
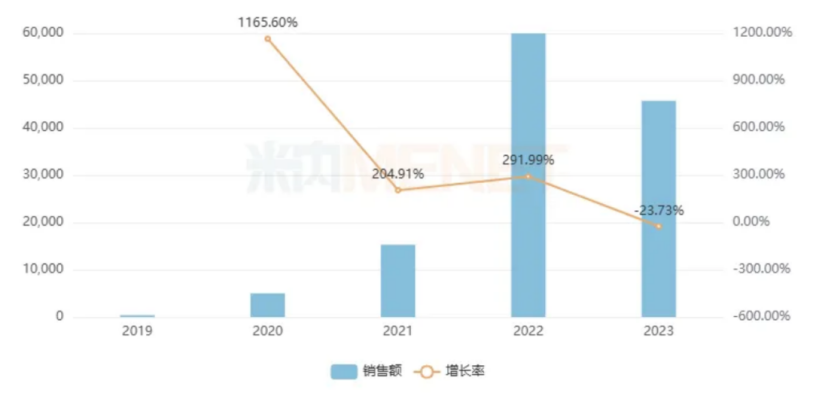
这一显著变化充分证明了医保谈判对于提高药物可及性、减轻患者负担的重要作用。米内网数据显示,诺西那生钠在公立医疗机构终端的销售额在2022年涨至接近6亿元,2023年虽有略有下降,但仍保持在近5亿元的水平,充分证明了其在国内市场的巨大潜力和广阔前景。
面对这一庞大的市场,国内药企也纷纷布局诺西那生钠的仿制药。截至目前,重庆药友制药和齐鲁制药均已按注册分类4类提交了诺西那生钠注射液的仿制药上市申请,并获得受理。虽然诺西那生钠的中国核心专利于2030年才到期,仿制药尚需等待一段时间才能上市销售,但其未来对渤健市场的冲击和患者治疗负担的减轻作用将不容小觑。
三雄割据SMA市场
新适应症、新剂型搅动格局
近年来,罕见病治疗领域取得了令人瞩目的进展。目前在全球范围内,SMA治疗领域已有三款新药获批上市,除了渤健的诺西那生钠注射液,还有罗氏的利司扑兰(Evrysdi)和诺华的Zolgensma。
其中,罗氏开发的利司扑兰是一种SMN2基因mRNA剪接修饰剂,能够通过双位点特异性调控SMN2的剪接,促进保留外显子7,提高功能性SMN蛋白水平。此外,该药还可穿透血脑屏障,分布于中枢和外周,提高全身多系统SMN蛋白水平,且保持稳定。
据悉,利司扑兰于2020年8月获美国FDA批准上市,用于治疗年龄为2个月以上婴幼儿和成人SMA患者,成为首款获得FDA批准治疗SMA的口服疗法。2022年6月,FDA批准利司扑兰扩展使用人群,用于治疗年龄为2个月以下SMA患儿。至此,该产品已经获批用于治疗所有年龄段的儿童和成人SMA患者。目前,罗氏还在开展利司扑兰的多项临床研究,试图扩大竞争优势。例如在一项开放标签、单臂、多中心研究RAINBOWFISH中,利司扑兰正被评估治疗出生至6周龄、基因诊断为SMA且尚未出现症状的婴儿。
在国内市场,利司扑兰于2021年6月首次获NMPA批准上市,用于治疗2月龄及以上SMA患者,开启了SMA口服治疗的新时代。2023年3月,利司扑兰也进入了国家医保,药品目录,从6.38万/瓶降至3780元/瓶,进一步减轻了患者的经济压力。2023年6月,该药再次获得NMPA批准上市,将适用人群拓展至16日龄及以上的SMA患者。
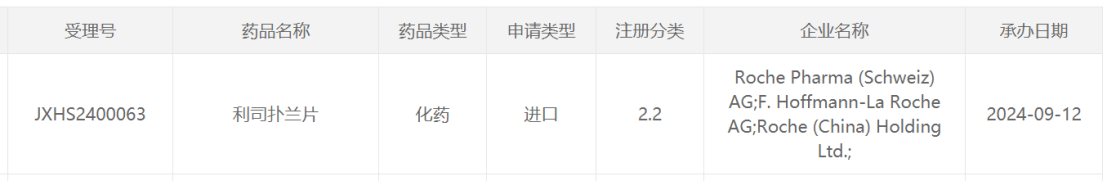
值得一提的是,此前获批的产品利司扑兰口服溶液是一种液体配方的药物,可以在家中口服或者通过饲管以液体形式给药。2024年9月,CDE官网显示,罗氏申报的利司扑兰片上市申请获得受理,具体适应症尚未披露。
而与同为化药的诺西那生钠和利司扑兰不同,诺华开发的Zolgensma是一种基于腺相关病毒载体AAV9的基因疗法,可将人类SMN基因的完整功能拷贝传递至目标运动神经元细胞中。2019年5月,Zolgensma首次获FDA批准上市,用于治疗2岁以下SMA的儿科患者。尽管Zolgensma有望通过一次给药达到终生有效的“治愈”效果,但其价格高昂,目前定价为212.5万美元/针。目前,Zolgensma在全球近42个国家/地区获批,但在中国还未获得批准,国内正处于Ⅲ期临床试验。
2024年12月,诺华宣布一项Ⅲ期随机、双盲、假对照STEER研究达到主要终点。该研究旨在评估一次性鞘内注射Zolgensma对未经治疗的2型SMA患者(年龄2至18岁,能够坐立但从未独立行走)的临床疗效、安全性和耐受性。据诺华透露,这是首个在两岁及以上未接受治疗的SMA患者中具有临床获益的试验性基因疗法。

研究结果显示,相较于对照组,接受鞘内注射Zolgensma治疗的SMA患者的Hammersmith 运动功能量表扩展版(HFMSE)总分较基线有所增加,这表明SMA患者的运动功能得到改善。详细数据将在2025年即将举行的医学会议上公布。
可以看到,SMA治疗领域的竞争格局正在逐步形成。诺华的Zolgensma和罗氏的利司扑兰作为重要的治疗药物,随着新适应症和新剂型的扩展,或将对渤健的诺西那生钠形成有力的竞争。
与此同时,也有多家国内药企在布局治疗SMA的创新药研发,部分药物已进入临床试验阶段。资料显示,杭州嘉因生物科技的EXG001-307、蓝图生物医药(广州)的Vesemnogene Lantuparvovec等皆已进入1/2期临床。其中,北京锦篮基因科技的GC-101腺相关病毒注射液于2024年12月被CDE纳入突破性治疗药物程序,拟定适应症为2型SMA。此外,九天生物医药(上海)/揽月生物医药科技(杭州)的腺相关病毒基因疗法SKG-0201则进入1期临床试验。这些新药的研发和上市,将进一步推动SMA治疗领域的竞争和发展,为整个市场带来新的活力和机遇。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx