2024 年美国血液学会(ASH)年会将于当地时间 12 月 7 日至 10 日间在美国圣地亚哥举行,目前摘要已经公布。恒瑞的 1 类新药 HRS-5965 将在本次会议上公布一项 II 期临床研究结果,单药治疗未接受补体抑制剂治疗的阵发性睡眠性血红蛋白尿(PNH)患者。

截图来源:ASH 官网
HRS-5965 是一种新型口服选择性补体因子 B(CFB)抑制剂,该因子是补体旁路途径的关键组成部分,可减少血管内和血管外溶血并导致无需输血即可改善血红蛋白水平,目前正在针对 PNH 进行临床开发。
本次公布的是 HRS-5965 的一项概念验证、多中心、随机、开放标签 II 临床研究结果 (NCT06051357),评估单药治疗未接受补体抑制剂治疗的阵发性睡眠性血红蛋白尿患者的疗效和安全性。主要终点是血红蛋白从基线到第 12 周的变化。
符合条件的患者按 1:1 的比例随机分为滴定剂量给药组和固定剂量给药组。

截图来源:Insight 数据库
研究者得出结论,在未接受补体抑制剂治疗的 PNH 患者中,HRS-5965 单药治疗 50 mg 或 75 mg 可降低 LDH 水平并且快速、持久、无需输血的改善血红蛋白水平。两种剂量均耐受良好。这表明 HRS-5965 可能代表了该患者群体的一种新的治疗选择。当前,静脉注射抗 C5 单克隆抗体(依库珠单抗/瑞利珠单抗)是治疗 PNH 患者的标准治疗 (SoC)。然而,研究显示高达 60% 的患者在 SoC 中出现临床意义的残留贫血,继发于 C3 介导的血管外溶血。虽然抗 C3 抑制剂 Pegcetacoplan 在第 16 周时显示出比依库珠单抗在临床和血液学结果上更优,尤其是在使用依库珠单抗治疗后仍有残余贫血的 PNH 患者中。然而,由于抗 C5 疗法和 Pegcetacoplan 分别需要静脉和皮下输注,因此对于有效的口服治疗方案的需求仍未得到满足。目前,全球已获批上市的 CFB 抑制剂只有诺华伊普可泮(Iptacopan ),是口服给药,已获批用于 PNH 和 IgA 肾病两项适应症,而且伊普可泮已经在头对头 III 期临床研究(APPLY-PNH )中打败了依库珠单抗和瑞利珠单抗。在今年 4 月,伊普可泮在国内获批用于 PNH。伊普可泮首次人体研究的中期结果数据为:所有 12 名可评估疗效的患者均达到了主要终点,大多数患者的血红蛋白 (Hb) 水平均获得了具有临床意义的改善,除 1 名患者外,其他所有患者截至第 12 周均无需输血。两种给药组(25 mg/100 mg、 50 mg/200 mg 组)中血红蛋白水平分别从基线时的 88.5 平均改善至第 12 周的 115.2 g/L(+26.7),从基线时的 76.9 改善至第 12 周的 109.0 g/L(+32.1)。平均 LDH 水平迅速而持久地下降,即在第 2 周两个队列分别下降 77% 和 85%,在第 12 周下降 86% 和 86%。HRS-5965 和 伊普可泮的临床数据对比 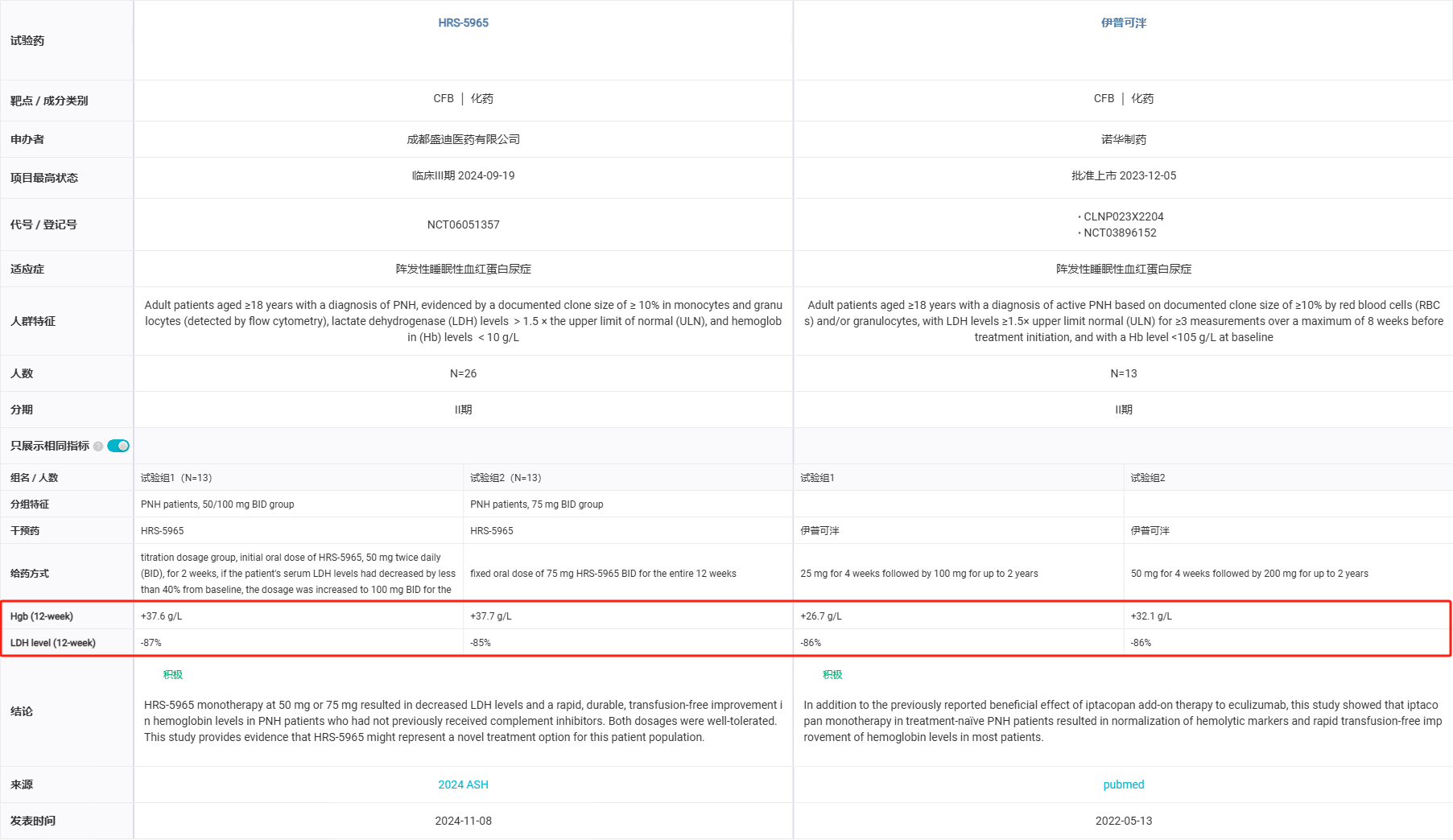
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx