面对瞬息万变的市场竞争,头部药企调整优化研发管线的速度越来越快。
日前,科伦药业更新了其控股子公司科伦博泰与默沙东相关合作项目的进展。值得注意的是,默沙东在行使独家选择权,向科伦博泰支付3750万美元,将一款针对肺癌、消化道肿瘤等多种实体瘤的创新双抗ADC SKB571收入囊中的同时,也将向科伦博泰退还Claudin18.2(CLDN18.2) ADC SKB315项目的开发、使用、制造及商业化的全球权益。
2022年以来,默沙东前后三次牵手科伦博泰,与后者的9款ADC药物达成超百亿美元合作。2022年7月,科伦博泰与默沙东达成合作协议,将SKB315的全球权益独家许可给默沙东,后者向其支付3500万美元不可退还的首付款,以及累计不超过9.01亿美元的里程碑金额,并按双方约定的净销售额比例提成。这也是继TROP2 ADC SKB264/MK2870后,默沙东从科伦博泰引进的第二款ADC产品。
病理状态下,CLDN18.2在胃肠道腺瘤、胰腺肿瘤等多种肿瘤中的表达显著上调,正在成为继HER2之后胃癌领域的第二重要治疗靶点,安斯泰来今年获批上市的同靶点单抗药物已经验证了该治疗概念。在CLDN18.2靶向药物开发大好形势下,默沙东选择向科伦博泰退货SKB315,其背后究竟有何深意?
以退为进
舍弃不占优势管线
作为传统的高发恶性肿瘤,胃癌在我国的发病率和死亡率居高不下。根据国家癌症中心今年2月在JNCC上发布的2022年中国恶性肿瘤疾病负担情况,2022年我国胃癌新发病例数约36万人,位列癌症新发第五位;死亡病例数达26万人,位列我国癌症死亡第三位。
由于具有高异质性、预后差等特点,我国胃癌患者过去的治疗情况并不乐观。有数据显示,2010-2014年我国胃癌患者5年净生存率仅为35.9%,远低于同期亚洲国家韩国(68.9%)和日本(60.3%)的水平。不过,随着近年来靶向和免疫治疗的探索与实践,这一情况正在改变。当前,胃癌治疗已经逐步向靶向治疗和免疫化发展,而CLDN18.2便是其中关注度最高的靶点之一。
在正常的生理条件下,CLDN18.2几乎不在健康组织中表达,但其在胃癌、胰腺癌、食管癌等多种肿瘤中呈高表达或异位激活,这种选择性表达让其成为一个极具治疗前景的药物靶点。相关研究显示,CLDN18.2表达呈阳性(定义为40%以上的肿瘤细胞IHC染色强度≥2+)的胃癌约占全部胃癌的49%-85%,而CLDN 18.2高表达胃癌约占全部胃癌的24%-36%。
如果能啃下CLDN18.2靶向药物这块“硬骨头”,势必将增强默沙东在胃癌这一治疗领域的话语权,这也是其当初大手笔从科伦博泰处引进SKB315的根本原因。据悉,作为一款针对晚期实体瘤治疗的创新型CLDN18.2 ADC,SKB315采用了科伦博泰自主研发的人源化CLDN18.2单抗以及独特的有效载荷-连接子设计。
其中,SKB315的新型CLDN18.2单抗有着高于基准(IMAB362)的细胞毒活性;有效载荷为新型TOPO1抑制剂(贝洛替康衍生物),药物抗体比(DAR)为7-8,加上专有设计以及可发挥旁观者效应,令这款药物有着更高的活性。早期临床数据显示,SKB315在胃癌CLDN18.2高表达领域疗效积极且安全性良好,科伦博泰表示相关数据将在后续学术会议中发表。
今年2月,默沙东在ClinicaltriaIs上注册了一项SKB315(MK-1200)的临床I/II期试验(NCT06242691),计划入组304人,预计在2026年1月完成。这项研究的目的在于评估该药单药治疗晚期/转移性胃或胃食管交界处(G/GEJ)腺癌、食管癌、胆道癌和胰管腺癌患者的疗效和安全性,这些患者已接受或不耐受所有已知的临床获益治疗。研究的第1部分将剂量递增以确定最大耐受剂量(MTD);第2部分将评估2种不同剂量SKB315的安全性和有效性。
尽管SKB315的早期数据还有待科伦博泰进一步披露,但业界也能从同类药物的进展中窥见其在胃癌领域的潜力。目前,国内已有四款CLDN18.2 ADC均披露进入注册性III期临床研究,分别是康诺亚/乐普生物/AZ联合开发的CMG901、信达生物的IBI343、恒瑞医药的SHR-A1904和礼新医药的LM302。
以CMG901为例,其用于治疗晚期G/GEJ腺癌的I期临床研究最新数据在2023年11月ASCO Plenary Series上以口头报告形式发布。数据显示,89例可评估的CLDN18.2阳性G/GEJ腺癌患者在三个剂量组的确认的客观缓解率(ORR)为33%,确认的疾病控制率(DCR)为70%。其中,2.2mg/kg剂量组确认的ORR为42%,中位无进展生存期(mPFS)为4.8个月,中位总生存期(mOS)尚未达到。
无独有偶,信达生物在2024年ESMO GI口头报告了IBI343治疗晚期G/GEJ腺癌的I期研究(NCT05458219)最新数据。结果显示,IBI343在CLDN18.2中、高表达G/GEJ腺癌患者中获得出色的疗效,尤其是在CLDN18.2高表达患者中,6mg/kg剂量组(N=30)的ORR和DCR分别为36.7%和93.3%,中位PFS达6.8个月;8mg/kg剂量组(N=17)的ORR和DCR分别为47.1%和88.2%,中位PFS达5.5个月。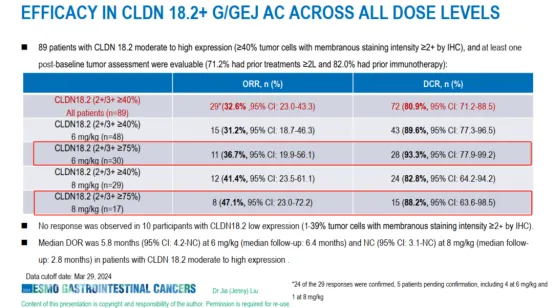
在业内看来,针对胃癌,与单抗相比,靶向CLDN18.2 ADC可能是一种更有效的治疗策略,因为ADC主要通过细胞毒性有效载荷及旁观者效应发挥抗肿瘤作用,这可能克服因肿瘤中CLDN18.2低表达或异质性,而让传统单抗的疗效受到限制的困难。而让默沙东不得不舍弃SKB315的主要原因或在于,该药在全球同类靶点中的开发进度并不占优势。
2024年3月,由安斯泰来开发的全球首款CLDN18.2单抗佐贝妥单抗在日本获批一线治疗CLDN18.2阳性、HER2阴性胃癌适应症。而截至2024年7月,围绕CLDN18.2靶点不同的药物机制,无论是单抗、双抗,还是ADC、CAR-T均有制药企业布局。尤其是在上述四款国产CLDN18.2 ADC均已进入注册冲刺阶段的背景下,默沙东选择退货也不难理解。
随着重新获得SKB315的全球权益,科伦博泰有望接棒继续推进该药的临床开发。科伦博泰在公告中表示,鉴于中国胃癌患者数量庞大,其对SKB315中国市场前景充满信心,将继续加快其在中国的开发,并采取合适的方式拓展海外市场。
多点发力
巩固胃癌领先地位
今年发布的全球癌症统计数据显示,胃癌是全球第五大癌症,也是导致癌症患者死亡的第五大原因。巨大而未被满足的临床需求,也让该治疗领域成为制药企业的必争之地。事实上,默沙东早已通过旗下的重磅品种PD-1抑制剂帕博利珠单抗(K药),在胃癌治疗领域占有一席之地。
2023年11月,基于KEYNOTE-859研究,美国FDA批准K药联合氟嘧啶和铂类化疗用于局部晚期或转移性HER2阴性G/GEJ腺癌的一线治疗。研究结果显示,与单独化疗相比,无论PD-L1表达如何,K药联合化疗在HER2阴性患者中的总生存期(OS)、无进展生存期(PFS)、客观缓解率(ORR)和缓解持续时间(DOR)等方面,均有统计学意义的改善。同年12月,该适应症也在国内获批。
而对于HER2阳性的胃癌患者,默沙东也并未放弃。2024年6月,基于全球III期临床试验KEYNOTE-811研究的数据,K药在国内获批联合曲妥珠单抗、含氟尿嘧啶类和铂类药物化疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥1)的局部晚期不可切除或转移性HER2阳性G/GEJ腺癌患者的一线治疗。此前,美国FDA已经基于这一试验的ORR和DOR数据,加速批准K药组合疗法一线治疗这些患者。
通过KEYNOTE-859和KEYNOTE-811两项研究,默沙东已在晚期胃癌一线治疗领域稳住了脚跟。不过,默沙东并未满足于此,而是继续拓展其在胃癌领域的市场地位,从科伦博泰引进的另一款靶向TROP2的ADC产品芦康沙妥珠单抗(SKB264/MK2870/sac-TMT)便是其重要抓手。
作为新一代的TROP2 ADC,芦康沙妥珠单抗由具有高亲和力和靶向性的人源化抗TROP2单抗,通过稳定性经过优化的CL2A连接子(连接子的抗体端采用甲磺酰基嘧啶与抗体实现不可逆偶联),与毒素小分子T030(拓扑异构酶Ⅰ抑制剂)结合而成,药物抗体比(DAR)平均高达7.4。目前,科伦博泰已经提交两个芦康沙妥珠单抗关于肺癌的上市申请。
在2024年AACR 年会上,研究者公布了芦康沙妥珠单抗针对经治晚期G/GEJ腺癌患者的Ⅱ期拓展研究初步成果。研究结果显示,疗效方面,在41例疗效可评估的患者中,芦康沙妥珠单抗单药治疗的ORR为22.0%,疾病控制率(DCR)达80.5%,mDoR为7.5个月。其中2L和3L+患者的ORR分别为27.3%和15.8%。值得关注的是,中位随访时间达14.6个月的3L+患者亚组(n=24,其中54.2%的患者既往治疗≥4线),mPFS为3.7个月,mOS为7.6个月,12个月OS率为32.6%。
当前,默沙东和科伦博泰正在加快推进芦康沙妥珠单抗在胃癌治疗领域的开发。根据科伦博泰公告,截至2024年6月30日,默沙东已启动10项芦康沙妥珠单抗作为单一疗法或联合K药或其他药物用于多种适应症的全球III期临床研究,其中就包括将芦康沙妥珠单抗用于三线及以上治疗晚期/转移性胃食管腺癌(GEA)的研究(NCT06356311)。该研究计划入组450例胃癌患者,预计2027年1月初步完成。
此外,默沙东此番行使独家选择权,从科伦博泰引进的SKB571也值得期待,这是一款新型双抗ADC,主要针对肺癌、消化道肿瘤等多种实体瘤。尽管并未透露具体的靶点,但有芦康沙妥珠单抗这一珠玉在前,业界对SKB571也寄予了厚望。临床前研究显示,SKB571在多种人源肿瘤异种移植(PDX)模型和食蟹猴中,分别展现了良好的抗肿瘤效果及安全性。科伦博泰透露,该产品将于近期递交IND申请。
在通过K药联用方案打开胃癌市场大门的背景下,果断舍弃研发进度靠后的CLDN18.2 ADC SKB315,加快推进应用前景广阔的TROP2 ADC芦康沙妥珠单抗,同时吸纳更具治疗潜力的新型双抗ADC SKB571,默沙东在消化道肿瘤上的打法愈加清晰,有望继续在ADC时代捍卫其在肿瘤领域的霸主地位。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx