 随着技术进步,FL领域双抗、CAR-T等多个细分赛道均有实力药企布局。新秀初来乍到,能否搅动池水,翻出更多创新的水花?
随着技术进步,FL领域双抗、CAR-T等多个细分赛道均有实力药企布局。新秀初来乍到,能否搅动池水,翻出更多创新的水花?2028年有望超40亿美元
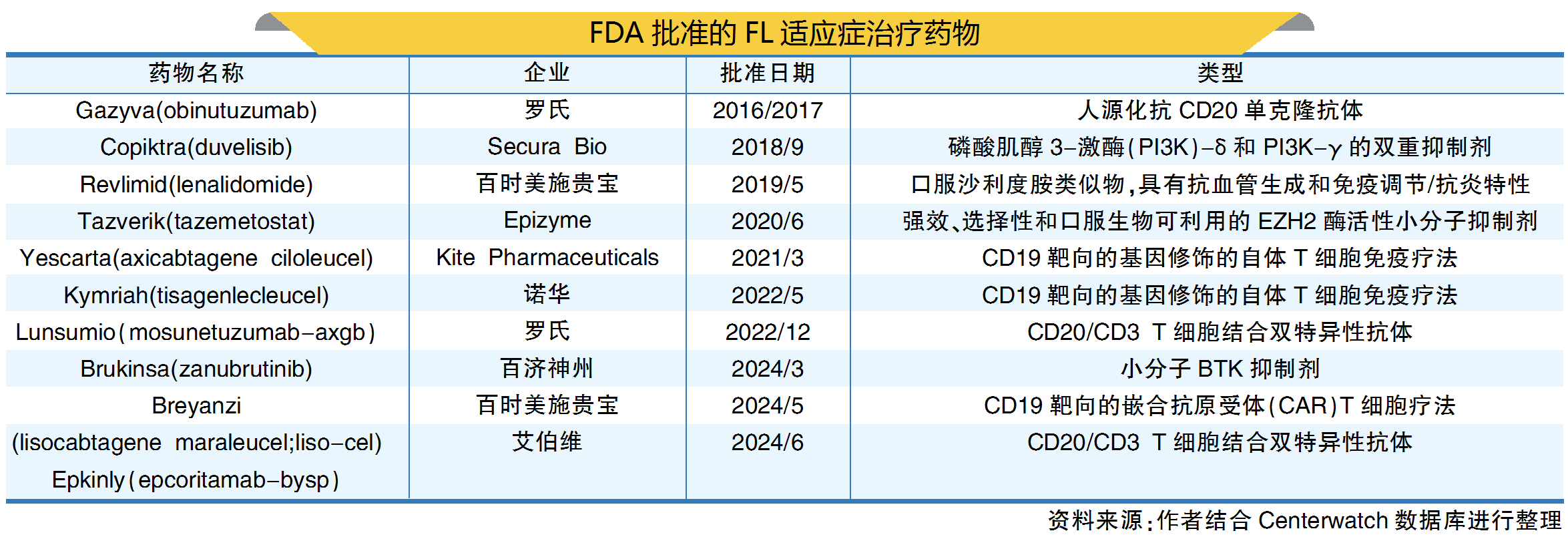
FL占所有NHL病例的20%~30%,主要治疗药物包括单克隆抗体、靶向药物、化疗、放射治疗、干细胞移植、烷化剂、核苷类似物、蒽环衍生物等。
在美国,FL是第二常见的NHL亚型,估计发病率为每年十万分之六。同时,FL是一种老年性疾病(中位年龄55岁),在儿童中比较少见。
近年来,全球FL治疗市场增长强劲。2023年,FL药物销售额达到28.3亿美元,预计到2028年,将以年复合增长率(CAGR)为8.0%的速度增长,届时药物销售额有望达到42亿美元。
双特异性抗体双雄争霸
FDA6月底做出的加速批准决定将使Epkinly与罗氏的Lunsumio面对面展开较量,后者在2022年年底获批成为FL的三线治疗药物。这两款药物都是CD20/CD3双特异性T细胞接合剂。
艾伯维指出,Epkinly是首款被批准同时用来治疗FL和弥漫性大B细胞淋巴瘤(DLBCL)的双特异性抗体。Epkinly在2023年5月获得FDA首次批准,用于DLBCL的三线治疗。在DLBCL治疗领域,罗氏正在销售另外一种CD20/CD3药物Columvi,并对Lunsumio作为组合药物的一部分用于早期治疗进行测试。
尽管如此,William Blair公司分析师Matt Phipps认为,由于Epkinly目前在后线治疗淋巴瘤适应症发力,这一市场规模有限,因此其近期扩张相对受限。与此同时,其竞争对手Lunsumio在FL和门诊就诊的适用性方面具有先发优势。
Epkinly最新获得批准基于Ⅰ/Ⅱ期EPCORE NHL-1试验得出的肿瘤缩小的数据。这项试验显示,在127名先前平均尝试过3种疗法的患者中,Epkinly的总缓解率(ORR)为82%,这其中包括60%的完全缓解。在对治疗作出反应者进行中位随访14.8个月之后,没有达到反应的中位持续时间。
Epkinly的疗效数据看起来与GO29781试验针对Lunsumio得出的结果非常相似,该试验得到的ORR为80%,完全缓解为60%。在对治疗作出反应者进行中位随访14.9个月之后,中位反应的持续时间估计为22.8个月。
从给药方式来看,与先入局者Lunsumio的静脉输注给药相比,后来者Epkinly具有皮下注射的优势。因此,罗氏正未雨绸缪,急切地推进双特异性皮下注射制剂的开发。从给药时间来看,罗氏开发的Columvi和Lunsumio具有给药固定持续时间,这意味着患者在几个周期之后可以停止治疗。相比之下,Epkinly的给药时间无限期,直到疾病发生进展或出现不可接受的毒性。艾伯维血液学治疗领域负责人Mariana Cota Stirner表示,皮下给药提供了便利性,患者可以使用三步递增给药方案使用Epkinly,而无需强制性住院。
想加入FL双特异性抗体赛道并非易事。在艾伯维和Genmab公司获得Epkinly用于FL药品标签的3个月前,FDA拒绝批准再生元的靶向CD20/CD3的双特异抗体odronextamab用于治疗FL和DLBCL。再生元表示,FDA拒绝批准的唯一原因是确证临床研究的入组进展问题。
值得注意的是,随着FL的后线治疗用途相继获得FDA的批准,人们对双特异抗体药物的关注点已经转向了早期治疗用途。
Genmab开展的Ⅲ期EPCORE FL-1试验正在将Epkinly与罗氏的Rituxan和百时美施贵宝(BMS)的Revlimid结合在一起,用于FL二线治疗。
罗氏也就Lunsumio和Revlimid用于二线治疗复发性/难治性(R/R)FL患者展开Ⅲ期CELESTIMO试验。与此同时,皮下注射Lunsumio制剂正推进Ⅱ期MorningSun研究。
CAR-T疗法三龙戏珠
今年5月,BMS生产的CAR-T疗法Breyanzi通过FDA加速批准,被用于此前至少接受过两种疗法的复发或难治性FL患者。
大约3年前,吉利德的Yescarta成为第一款进入FL治疗领域的CD19靶向CAR-T疗法。随后,诺华的Kymriah也获准三线治疗这种适应症。上述3款CAR-T疗法获得的加速批准都是基于肿瘤缩小数据。
BMS的Breyanzi凭借Ⅱ期TRANSCEND FL试验的结果赢得了FDA的批准。该药目前的标签显示,接受这款CAR-T疗法的患者其肿瘤缓解率为95.7%,其中完全缓解率为73.4%。完全缓解率明显低于去年6月对这项研究所做的初步分析得到的94.1%。
Breyanzi的中位反应持续时间尚未达到,77.1%对治疗做出反应者在18个月时仍处于缓解状态。
相比之下,在各自的试验中,吉利德的Yescarta和诺华的Kymriah在三线治疗FL中的总缓解率分别为91%和86%,完全缓解率分别为60%和61%。随着Breyanzi获得新的加速批准,BMS将针对这一适应症的确证性试验提上日程。今年3月,BMS注册了一项Ⅲ期试验TRANSFORM FL,将Breyanzi与研究人员选择的一种标准组合药物进行比较(用于此前接受过一种到三种疗法的FL患者),主要完成日期预计为2031年10月。
与此同时,吉利德旗下Kite Pharma公司正在对Yescarta开展Ⅲ期ZUMA-22试验,用于此前至少尝试过一种系统疗法的患者。这项试验于2022年9月开始,主要完成日期为2030年。这两项CAR-T研究都将无进展生存期作为主要终点。
BTK抑制剂金花傲立
大约一年前,艾伯维和强生的BTK抑制剂Imbruvica在Ⅲ期试验阶段折戟。当年6月公布的数据显示,对既往接受过治疗的FL或边缘区淋巴瘤患者,将Imbruvica加入到化学免疫疗法中可将患者的疾病进展或死亡风险降低19%。这个数据没有达到统计学意义。此后,FL治疗领域BTK抑制剂赛道一直翘首以盼破局者。
百济神州在今年3月成功入局,彼时FDA加速批准其Brukinsa(泽布替尼)联合罗氏的抗CD20抗体Gazyva,用于此前至少接受过2种系统疗法的FL患者。
百济神州血液学首席医疗官Mehrdad Mobasher表示,Brukinsa目前是美国市场上首款被批准用于治疗FL的BTK抑制剂,在用于各种血液学适应症的药物中拥有范围最广泛的标签。
然而,在后线治疗FL中,Brukinsa组合药物将面临来自CAR-T疗法和双特异性抗体的竞争。
Brukinsa获批用于这一适应症是基于Ⅱ期ROSEWOOD试验得出的肿瘤缩小的数据。在中位随访大约20个月之后,Brukinsa-Gazyva组合药物在69%的患者中激发了反应,明显优于Gazyva单药治疗组46%的总缓解率。在治疗18个月之后,69%使用这一组合药物的患者病情继续得到缓解,而单独使用Gazyva的患者病情缓解的比例为42%。
在次要终点上,接受组合药物治疗的患者没有发生疾病进展的时间更长。组合用药的中位无疾病进展期为28个月,而对照组大约为10个月。
就疗效来说,Brukinsa在FL治疗领域面临着激烈的竞争。Mobasher表示,尽管Brukinsa-Gazyva的疗效似乎弱于CAR-T疗法,但该方案提供了即用型选择,而个体化细胞疗法需要数周的生产时间才能到达患者手中。
此外,CAR-T和双特异性药物都需要对患者监测细胞因子释放综合征这种潜在性危险副作用。
目前,百济神州还没有关于Brukinsa-Gazyva组合药物在使用CAR-T或双特异性治疗后是否仍然有效的数据。Mobasher认为,医生将会根据患者的健康状况、其他药物的可用性和每家医疗机构的能力来决定采取合适的三线治疗方案。
作为加速批准的一部分,Brukinsa将在Ⅲ期MAHOGANY试验进一步证明疗效。这项试验将对Brukinsa-Gazyva与BMS的Revlimid和罗氏Rituxan的组合药物用于FL或边缘区淋巴瘤患者进行比较,这些患者此前至少尝试过一种治疗方法。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx