纯化水(PW:purified water)在制药行业常见常用,在制药行业中占据重要地位,广泛应用于药物制剂的配制、提取和清洗等多个环节。然而,相较于国际药典标准,我国《中国药典》在纯化水质量控制项目上尚存差距。为提升标准的科学性与合理性,并与国际接轨,国家药典委员会于2024年4月24日公示了《关于0261制药用水标准草案》。这一新标准旨在向国际先进标准看齐,通过引入风险评估等手段,为药企提供了更为灵活和高效的质量控制方法,对QC工艺用水检测人员而言无疑是一大福音,标志着我国制药用水标准的显著进步。本文旨在对纯化水质量控制项目进行快速解读,并提炼出其中的关键要点,以期为相关从业人员提供参考。
一、纯化水法规相关要求
中国《药品生产质量管理规范》(GMP)及相关法规对制药用水,尤其是纯化水有严格要求。GMP强调制药用水应适合其用途并符合《中国药典》质量标准,要求储罐和管道材料无毒、耐腐蚀,并避免微生物滋生。药典规定纯化水应通过蒸馏、离子交换等方法制备,质量须符合规定,可用于多种制剂的配制和提取,但不得用于注射剂。最新公示的《0261制药用水标准草案》进一步强调了对元素杂质和微生物污染的控制,确保纯化水在制备、储存和分配过程中的质量与安全。
笔者梳理了我国各监管机构对纯化水法规相关要求,如下表:

二、纯化水检验项目有哪些?
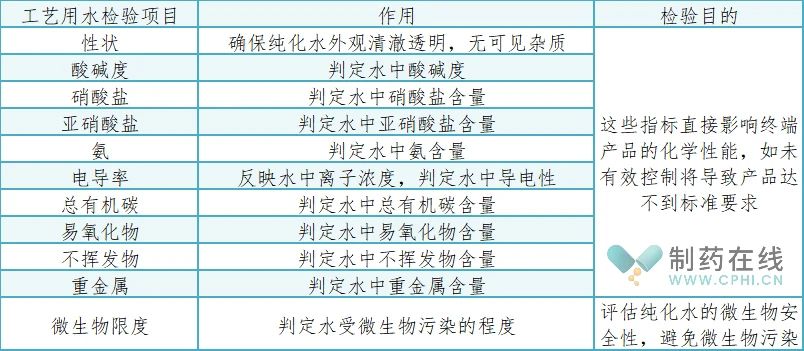
2020年版《中国药典》纯化水检测指标共有10项,分别是:性状、电导率、总有机碳/易氧化物、微生物限度、pH值、硝酸盐、亚硝酸盐、氨、不挥发物、重金属。纯化水的质量控制指标作用和检验目的如下表:
纯化水的质量控制指标作用和检验目的
《关于0261制药用水标准草案的公示》对比《中国药典》2020年版,分析显示主要修订项目如下:
1. 性状:
删除了“无臭”的描述,与《国家药用辅料标准编写细则》保持一致。
2. 酸碱度:
结合各国药典与USP<1231>氯-氨模型的指导,药典委对酸碱度检查项进行了修订。通过采用制药用水电导率测定法(通则0681)中注射用水测定法来测定电导率,当电导率符合规定时,溶液的pH值自然能够保持在5.0~7.0的范围内,这一范围严格覆盖了原酸碱度检查中甲基红指示液和溴麝香草酚蓝指示液所覆盖的pH值范围。因此,基于电导率的准确测定,药典委提议不再单独进行酸碱度检查,以简化检测流程并确保药品生产用水的质量。
3. 硝酸盐:
在国际药典的对比中,美国药典和日本药典均未设立硝酸盐检查项。而欧洲药典指出,当散装纯化水的电导率符合注射用水标准时,无需单独检测硝酸盐。综合各国药典的考量,药典委将对硝酸盐检查项进行修订。新的检测方法将采用多阶段电导率测试(三步法),以更高效地评估纯化水的质量,同时减少无机离子化学测试的繁琐步骤,确保药品生产用水的纯净度和安全性。
4. 亚硝酸盐:
参考各国药典,修订此项。用多阶段电导率测试(三步法)替代无机离子化学测试。
5. 氨:
经过对国际药典和氨模型的深入研究,药典委修订了纯化水中氨的检查标准。以0.3 ppm(0.00003%)作为氨的限度浓度,建立了相应的氨模型。当纯化水的电导率低于或等于1.3μS/cm(25℃)时,预期氨的浓度将被有效控制在0.3 ppm以下。这一调整是基于注射用水电导率判定法的第一步判定标准,确保纯化水在药品生产中的纯净度和安全性。
6. 不挥发物:
不挥发物检查是通过称重法测量水蒸发后的残渣,以控制非挥发性有机物和无机物。虽然现代化净水技术能有效去除水中不溶性胶体,但某些非解离不溶物如二氧化硅、铁锰胶体等仍需关注。鉴于当前技术发展和国际药典的参考,建议修订不挥发物检查项,并在“注”中增加安全性提示,鼓励企业基于风险评估选择是否进行该检查。同时,明确测定方法,落实企业风险管理责任,确保纯化水质量。
7. 重金属:
纯化水中重金属检查至关重要。欧洲药典对电导率不符合的纯化水要求进行元素杂质风险评估。我国则采用化学沉淀法主要检测铅含量,研究表明,当电导率符合规定时,铅含量可控在0.1ppm以下。参考各国药典及研究结果,修订此项。
这些变更旨在使纯化水的质量标准更加明确、科学,并与国际标准接轨,同时减少不必要的检测步骤,提高检测效率。纯化水控制要求汇总见下表。
纯化水质量标准对比表

参考文献
[1] www.chp.org.cn中国药典委员会官网
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx