卫材和渤健联合开发的阿尔茨海默病(AD)新药Leqembi(Lecanemab,仑卡奈单抗),或将很快面临对手礼来Donanemab的“贴身肉搏”。
日前,美国FDA外周和中枢神经系统药物咨询委员会(PCNS)以“11:0”全票通过的结果,支持礼来AD药物Donanemab的有效性,且一致认为其益处大于风险。尽管Donanemab的上市监管决定仍最终将由美国FDA做出,但咨询委员会提供的建议将成为前者判断的重要考量因素。

这是继去年7月Ⅲ期临床研究达到主要终点之后,Donanemab取得的又一大重磅里程碑进展。一致性的投票结果无疑为Donanemab获批上市注入一剂强心针,其或有望成为继卫材/渤健的仑卡奈单抗之后,第二个获批上市的同类药物。
致病机制不明、动物模型难验证、临床开发难等多重因素叠加,决定了AD药物研发是一块“难啃”的骨头。在过去相当长的一段时间里,包括礼来、辉瑞、罗氏等在内的制药巨头,都对AD新药投入了巨额经费研发,然而大部分都以失败告终,这也让AD新药被称为“研发黑洞”。
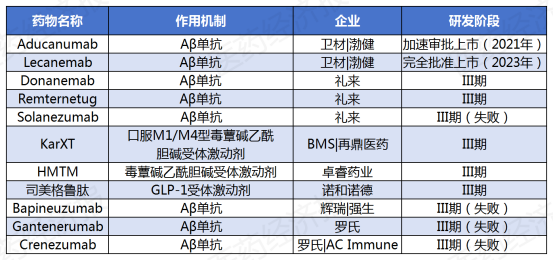
部分开展Ⅲ期临床的阿尔茨海默病新药
但现如今,AD治疗领域的领跑者已然打开了这座“金矿”尘封已久的大门,卫材和渤健已是第二次成功闯关美国FDA。可以预见的是,一大批跟随者将很快接踵而至,而市值突破8000亿美元大关的礼来将会是卫材和渤健面对的首位强劲对手。
PCNS全票通过
礼来Donanemab获批在望
AD是一种常见的退行性神经疾病,其发病率随年龄增长而显著上升。据世界卫生组织(WHO)估计,2023年全世界有5500万AD患者;而随着全球人口老龄化不断加剧,到2050年,这一数字可能增加到1.39亿,这将给患者、家庭以及社会带来更为沉重的负担。
2023年7月,由渤健与卫材共同开发的靶向β-淀粉样蛋白(Aβ)的AD抗体仑卡奈单抗获批上市,成为20年来首款获得美国FDA完全批准的AD新疗法。这次获批主要基于大型全球Clarity AD临床试验的Ⅲ期数据,与安慰剂相比,所有早期AD患者(MCI和轻症AD)经仑卡奈单抗治疗18个月时,终点指标临床痴呆症评分总表 (CDR-SB)的临床下降减少了27%。根据渤健2023年财报,仑卡奈单抗在2023年获批之后,全球销售额约为1000万美元。
紧随其后的礼来于2023年7月向美国FDA提交了其开发的Aβ单抗Donanemab的新药上市申请。这次申请主要基于Ⅲ期临床试验TRAILBLAZER-ALZ 2研究,所有早期AD患者经Donanemab治疗19个月时,终点指标AD综合评分量表(iADRS)的下降减少22% ,CDR-SB 下降减少29%。
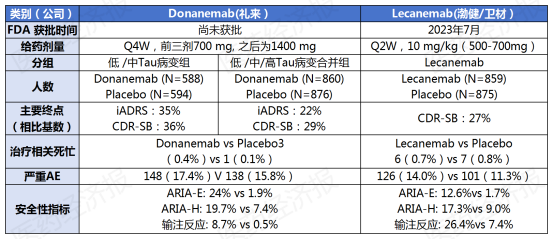
Donanemab与仑卡奈单抗的疗效和安全性指标对比情况
随着此番获得PCNS一致性的投票结果,礼来Donanemab获批上市的可能性大大增加。业内预期,或在1-2个月后就能看到美国FDA较为积极的监管审批决定。
倘若Donanemab成功获批上市,将为礼来在争夺庞大的AD治疗市场中奠定显著优势,使其在与辉瑞、罗氏、强生等跨国制药巨头的竞争中抢得先机,同时给渤健和卫材的仑卡奈单抗的市场独占地位带来直接的竞争压力。
值得一提的是,即使药物获得监管机构的批准上市,其市场表现和接受度也可能面临多种挑战。
2021年6月,由渤健和卫材共同研发的AD药物阿杜那单抗(Aducanumab)获得美国FDA的加速批准,但其有效性和安全性饱受争议,销售额亦未达到市场预期。渤健财报显示,阿杜那单抗在2022年的销售业绩仅为480万美元,尽管同比增长了60%,但与渤健其他药物的销售情况相比并不理想。
在被卫材放弃之后,今年2月,渤健也表示停止对阿杜那单抗的开发和商业化,此前发明阿杜那单抗的瑞士公司Neurimmune将重新获得该药的全部权利。渤健表示,经过进一步分析临床试验数据后,不再认为该药在临床试验中有效,还将终止一项关于阿杜那单抗正在进行的临床试验,该试验旨在证明该药对早期AD患者的获益。
阿杜那单抗不仅是2003年以来美国FDA批准的首个治疗AD的新型疗法,也是首个可以治疗AD相关认知功能下降的药物,其备受市场争议的上市故事犹如连续剧吸引了业界众多目光。现如今,这款曾经的“先驱”似乎已经成为“先烈”。
业内曾推测,阿杜那单抗在2026年将达到48亿美元的销售额,但实际的财报数据与该数字相差甚远。随着渤健决定放弃阿杜那单抗的临床开发和商业化,该药近二十年的传奇故事也走向结束。
在业内看来,由于在今年先后披露突破性进展,礼来的Donanemab和渤健/卫材的仑卡奈单抗成为当下最热门的AD药物,都有着巨大的潜在市场。但在上市时间上,Donanemab已经落后仑卡奈单抗,这也给礼来的反超增加了一定困难。尽管Donanemab的上市已是板上钉钉,但其上市后所面临的问题仍旧紧迫。更广泛患者的有效性如何,哪一部分患者更获益,往往还需要长期观察和评估。
从Aβ到Tau
百亿蓝海角逐加码
据WHO预测,中枢神经系统(CNS)疾病将在未来20年内成为第二致死源。当前,以AD、肌萎缩性脊髓侧索硬化症(ALS)等为代表的CNS疾病是公认的药物治疗贡献度最低和临床未满足需求最高的疾病领域之一。公开数据显示,2019年全球CNS药物市场规模为1245亿美元,为第四大药物市场。
据预测,全球CNS药物市场将保持稳定增长态势,2034年达到1721亿美元规模,而AD便是其中一座等待挖掘的“金矿”。
目前,我国已经步入老龄化社会,根据《国家人口发展规划(2016-2030)》,预计2030年全国总人口将达到14.5亿,60岁以上老年人占比25%。人口老龄化不仅是社会人口结构的改变,更重要的是还要面对疾病图谱的变化,尤其是以AD为主要代表的老年患者群体的激增。根据长江证券研报测算,国内AD用药市场规模预计将分别于2025年、2030年达到131亿元、684亿元。
AD药物虽有“研发黑洞”之称,但面对巨大的市场潜力,目前各大药企也并没有放弃这一治疗领域,仍旧在不断发力。
除了Donanemab,礼来旗下还有一款治疗AD的抗体疗法——Remternetug,正在中国进行Ⅲ期临床研究。该药物提供静脉注射和皮下注射两种剂型,其中皮下注射剂型的给药方案为每周一次,极大地提高了给药的便利性。
而诺和诺德的明星产品GLP-1受体激动剂口服司美格鲁肽也正在AD领域进行Ⅲ期临床研究。2022年的动物研究显示,GLP-1受体激动剂能够改善记忆和学习能力,增加神经元数量,减少Aβ蛋白的积累,并防止Tau蛋白累积。
今年3月,新加坡卓睿药业在2024年葡萄牙里斯本召开的阿尔茨海默病与帕金森病会议(AD/PD 2024)上汇报了其靶向Tau蛋白的AD疗法甲磺酸氢甲硫堇(HMTM)在Ⅲ期临床试验(LUCIDITY 试验)的24个月研究数据。与对照组相比,试验组的疾病进展显著减少,而且在早期疾病患者亚群中,疾病进展到AD痴呆阶段的患者显著减少。
Tau靶点是Aβ靶点外的另一个被业界看好的AD适应性靶点,业内分析认为,HMTM有潜力成为用于治疗AD的首款口服抗Tau蛋白疗法。2022年3月,HMTM在国内获批开展用于轻度至中度AD包括AD引起的轻度认知障碍患者的临床试验。
国内方面,先声药业引进了德国药企Vivoryon开发的两款AD治疗药物,分别为靶向 N3pE 的口服小分子谷氨酰肽环转移酶(QPCT)抑制剂 Varoglutamstat (PQ912) 和单克隆 N3pE 抗体 PBD-C06,交易金额超过5.65亿美元。此外,恒瑞医药的Aβ单抗SHR-1707在2022年12月启动了第2项Ⅰ期临床研究;润佳医药同样有一款Aβ单抗RP902,目前正处于临床I期阶段。
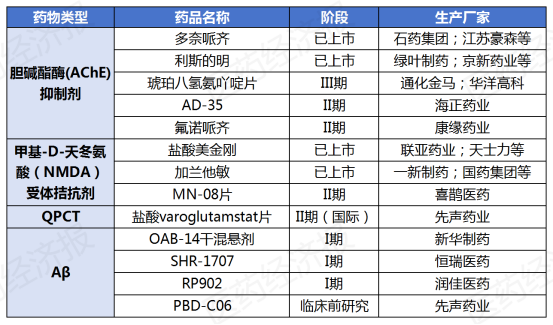
国内主要AD药物研发进展
总体来说,AD药物作为蓝海市场仍有较大的挖掘空间,目前Aβ机制领域管线较为丰富,Tau机制领域渐入佳境。AD治疗领域正处于发展阶段,随着业界对AD病理机制的深入理解,有望出现更多创新和有效的治疗方法,在为患者带来新希望的同时,也将拓展AD市场的更大发展空间和商业潜力。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx