2024年5月30日,国家药监局食品药品审核查验中心官网重磅发布了"关于再次公开征求《麻醉药品精神药品和药品类易制毒化学品生产安全管理指南》意见的通知"(成文时间:2024年5月30日),会稿截止日期2024年6月6日,本次修订的《麻醉药品精神药品和药品类易制毒化学品生产安全管理指南》是对原有指南的全面升级和完善,将为特殊药品的生产安全管理提供更加明确和具体的指导,有助于提升我国特殊药品的生产安全管理水平,保障公众用药安全,本文对《麻醉药品精神药品和药品类易制毒化学品生产安全管理指南》中修订背景、适用范围和机构和人员主要变化内容进行了分析。
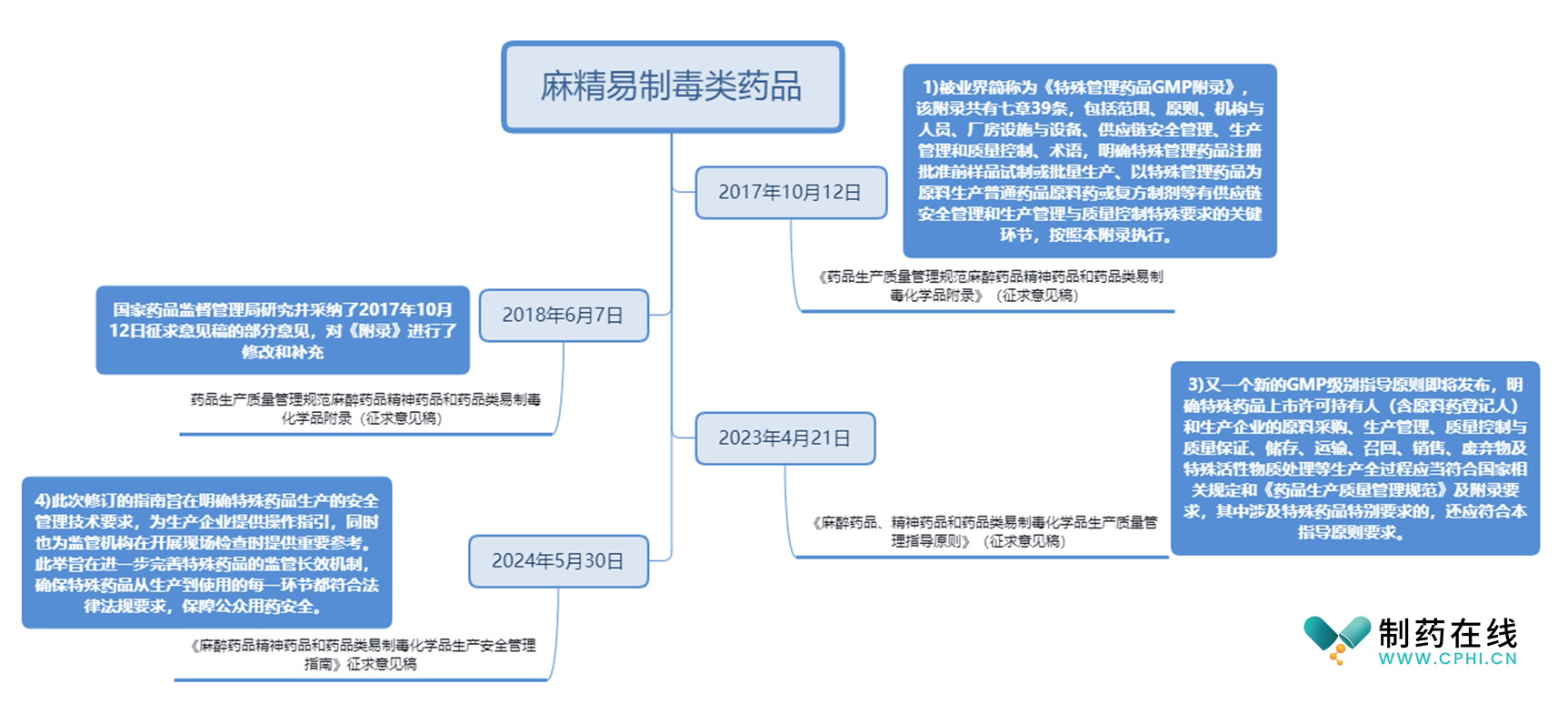
一、麻精易制毒类药品新规修订背景
为进一步提升麻醉药品、精神药品和药品类易制毒化学品(简称"特殊药品")的生产质量管理水平,确保生产过程中的安全性与合规性,此次修订的指南旨在明确特殊药品生产的安全管理技术要求,笔者梳理了麻精易制毒类药品相关法规的修订沿革,如有遗漏,欢迎大家留言补充。
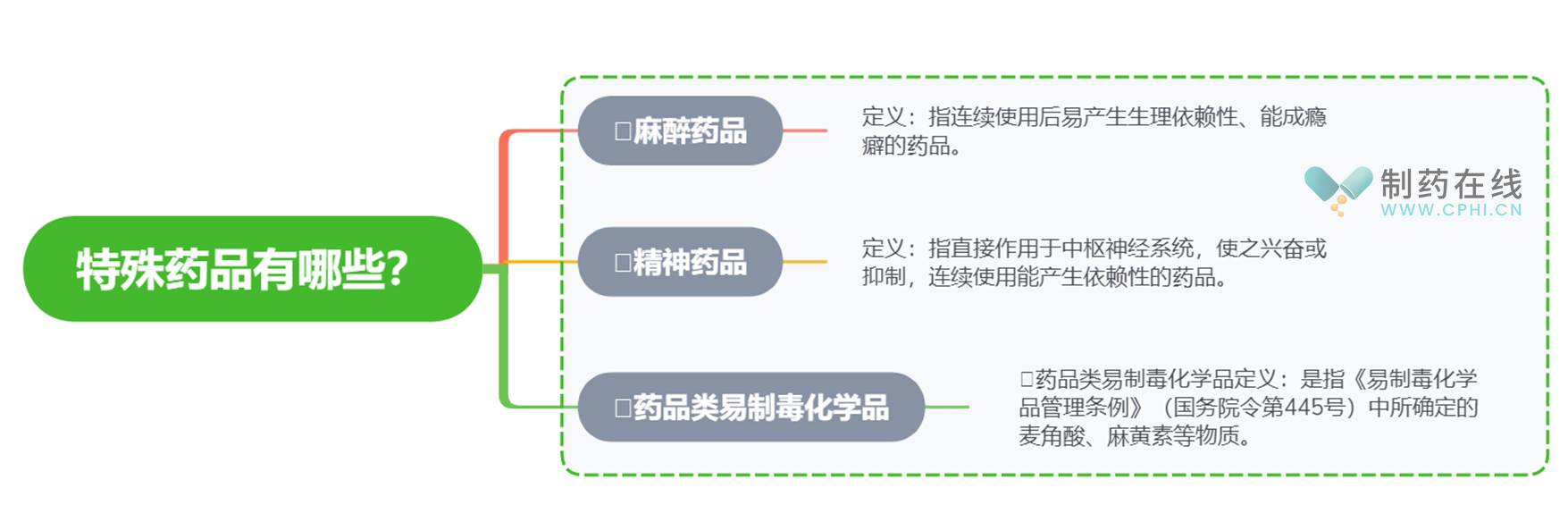
二、特殊药品有哪些?
特殊药品是指根据《中华人民共和国药品管理法》和国务院相关规定,受到国家特殊管理的药品类别。这些药品主要包括麻醉药品、精神药品和药品类易制毒化学品,《麻醉药品精神药品和药品类易制毒化学品生产安全管理指南》所指特殊药品为列入麻醉药品品种目录、精神药品品种目录和药品类易制毒化学品品种目录的品种,那么这三种特殊药品如何定义呢?
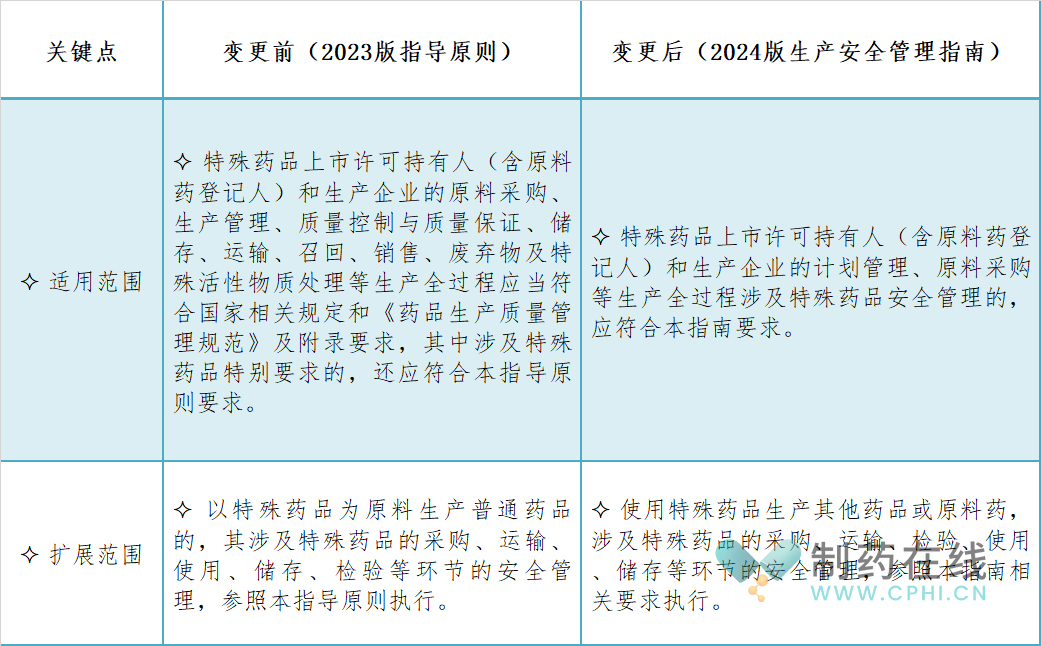
三、适用范围-安全管理有哪些考虑?
变更后的适用范围更为明确和具体,直接指向了涉及特殊药品安全管理的生产全过程,如计划管理、原料采购等。这体现了对特殊药品安全管理重要性的进一步强调和细化。
四、机构与人员-安全管理有哪些考虑?
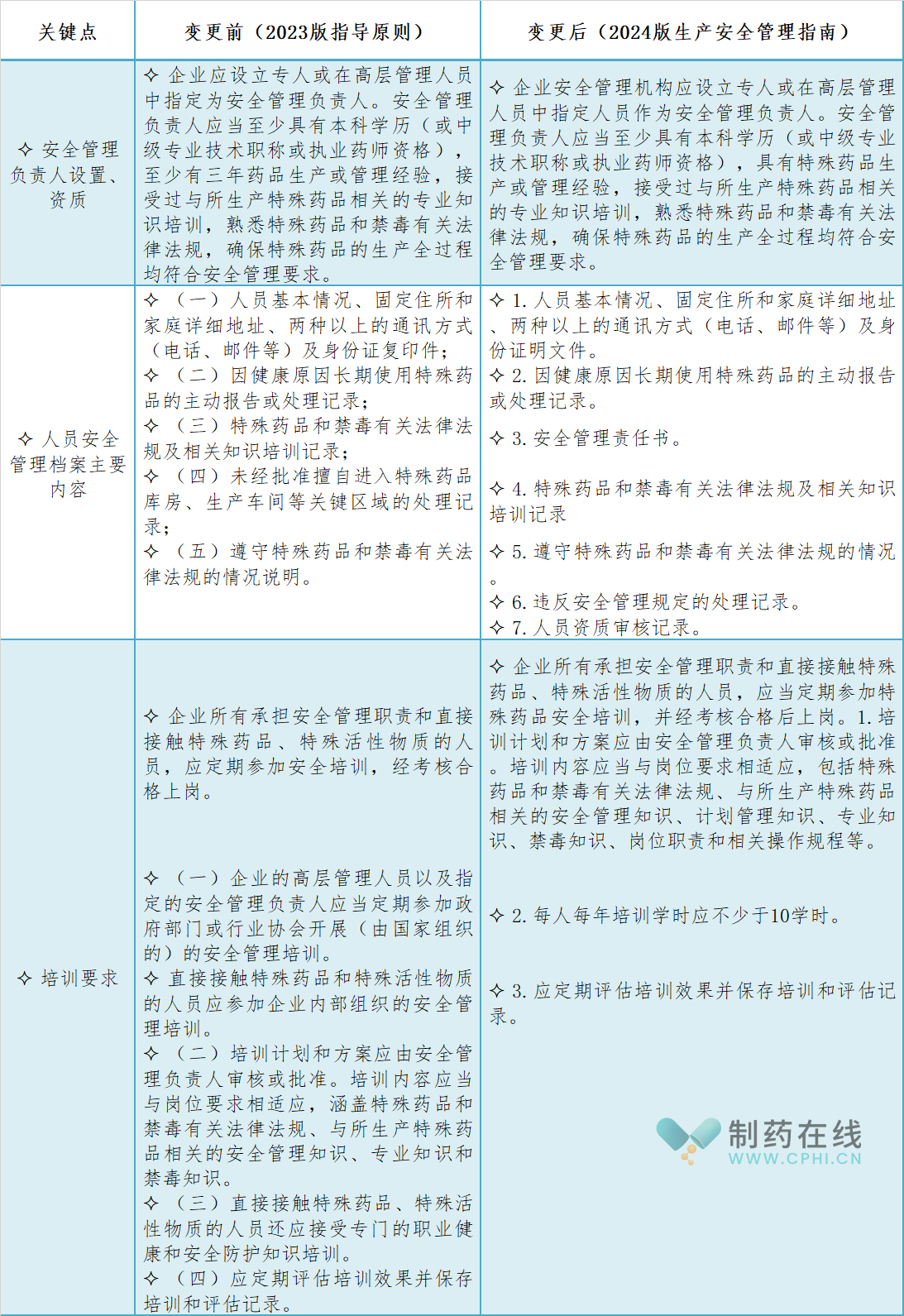
企业应当设立安全管理机构和安全管理受权人,规定机构设置和人员配备原则以及安全管理受权人资格条件和职责,并要求对接触特殊管理药品和特殊活性物质的所有人员进行培训并建立档案。主要变化点包括但不限于:
1.安全管理负责人设置、资质:
资质要求与变更前保持一致,即至少具有本科学历(或中级专业技术职称或执业药师资格),但更强调了对"特殊药品生产或管理经验"的需求,而不再具体提及"至少有三年"的药品生产或管理经验。这样的变化可能意味着对于安全管理负责人的实际工作经验更加重视其特殊药品生产或管理的相关性,而非简单的年限要求。
2.人员安全管理档案主要内容:
(1) 人员基本信息:与变更前相同,包括人员基本情况、联系方式等,但将"身份证复印件"更改为"身份证明文件",这可能意味着接受更多种类的身份证明,如护照等。
(2) 健康原因使用特殊药品记录:与变更前相同,继续关注因健康原因长期使用特殊药品的情况。
(3) 新增安全管理责任书:明确要求记录安全管理责任书,这可能是一份明确个人在安全管理中职责和责任的书面文件。
(4) 法律法规培训记录:与变更前相同,要求记录特殊药品和禁毒有关法律法规及相关知识的培训情况。
(5) 法律法规遵守情况:不再要求详细的"情况说明",而是更简洁地要求记录遵守情况。
(6) 新增违规处理记录:增加了违反安全管理规定的处理记录,这是对违规行为进行追踪和管理的明确要求。
(7) 新增人员资质审核记录:要求记录人员资质审核的情况,这有助于确保所有涉及特殊药品生产和管理的人员都具备相应的资质和能力。
3.培训要求
(1) 培训学时要求:新增了每人每年培训学时应不少于10学时的具体量化要求。
(2) 培训内容扩展:在原有基础上,增加了"计划管理知识"、"岗位职责"和"相关操作规程"等内容,使培训内容更加全面和具体。
(3) 培训组织和对象:虽未明确提及培训组织方式,但整体要求仍然适用于所有承担安全管理职责和直接接触特殊药品、特殊活性物质的人员。
(4) 培训效果评估:与变更前一致,要求定期评估培训效果并保存培训和评估记录。
参考文献
[1] NMPA等
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx