来源:药渡
撰文:滴水司南
编辑:维他命
2023年,中国药品审评中心(CDE)迎来了政策创新的高峰,为新药研发定下基调。在这一年,CDE不断优化指导原则体系,针对药物评价和研发共性问题提供规范标准,旨在提升企业的研发质量和效率。药品注册法规的更新调整映射了国家对药品质量安全的极致重视,也对药品研发带来了挑战与机遇。
通过分析国家药品监督管理局CDE网站及《2023年度药品审评报告》,本文总结了今年CDE在药品注册法规上的新动向。对制药行业而言,紧跟CDE的步伐是获取专业知识、实现突破的关键。行业内应密切关注这些变化,并及时更新企业政策,以保持竞争力。
PART.
01
2023年CDE药品注册法规政策全景梳理在2023年,中国药品审评中心(CDE)坚守国际化理念并结合国内实际情况,连续发布多项药品注册技术指导原则。这些原则有效填补了国内体系空白,激发了行业的研发创新热情,同时实现了审评标准的统一和审评能力的提升,确保审评决策的科学性。
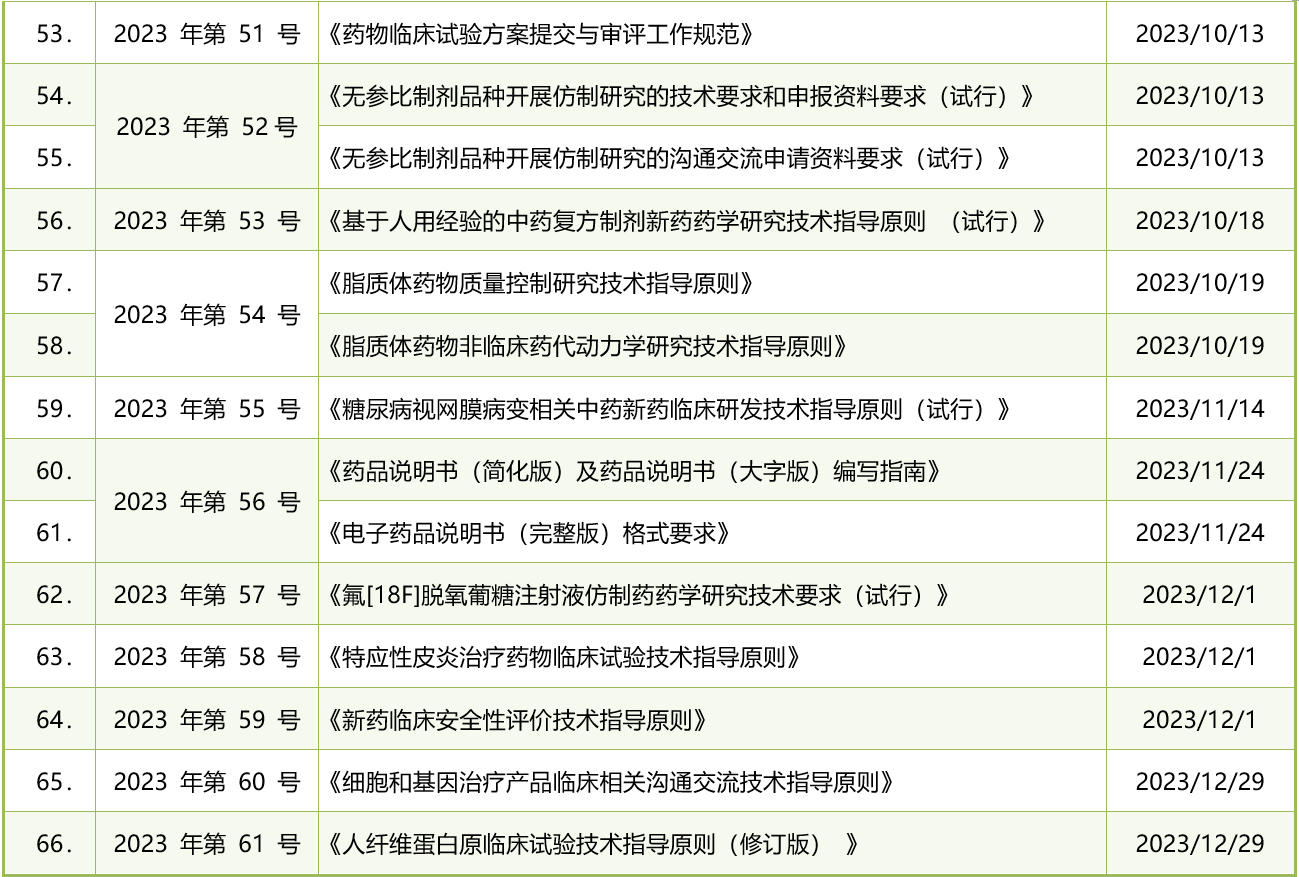
截至2023年12月31日,CDE累计共发布了66份与药品注册相关的法规政策文件。其中包括60个技术指导原则和其他6个指南,这些文件以61个技术指导原则通告文号的形式公布。平均每月CDE大约发布6份此类文件。以下是详细清单:
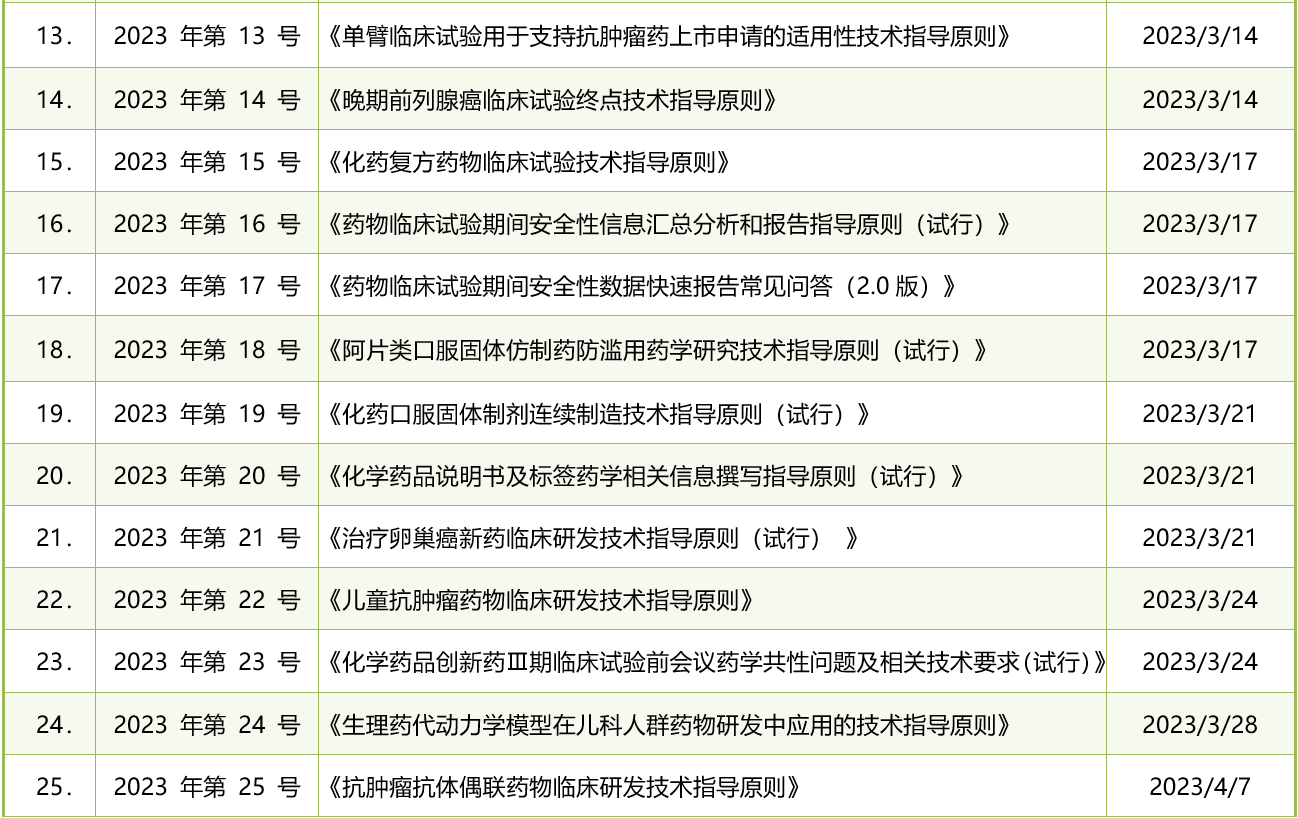
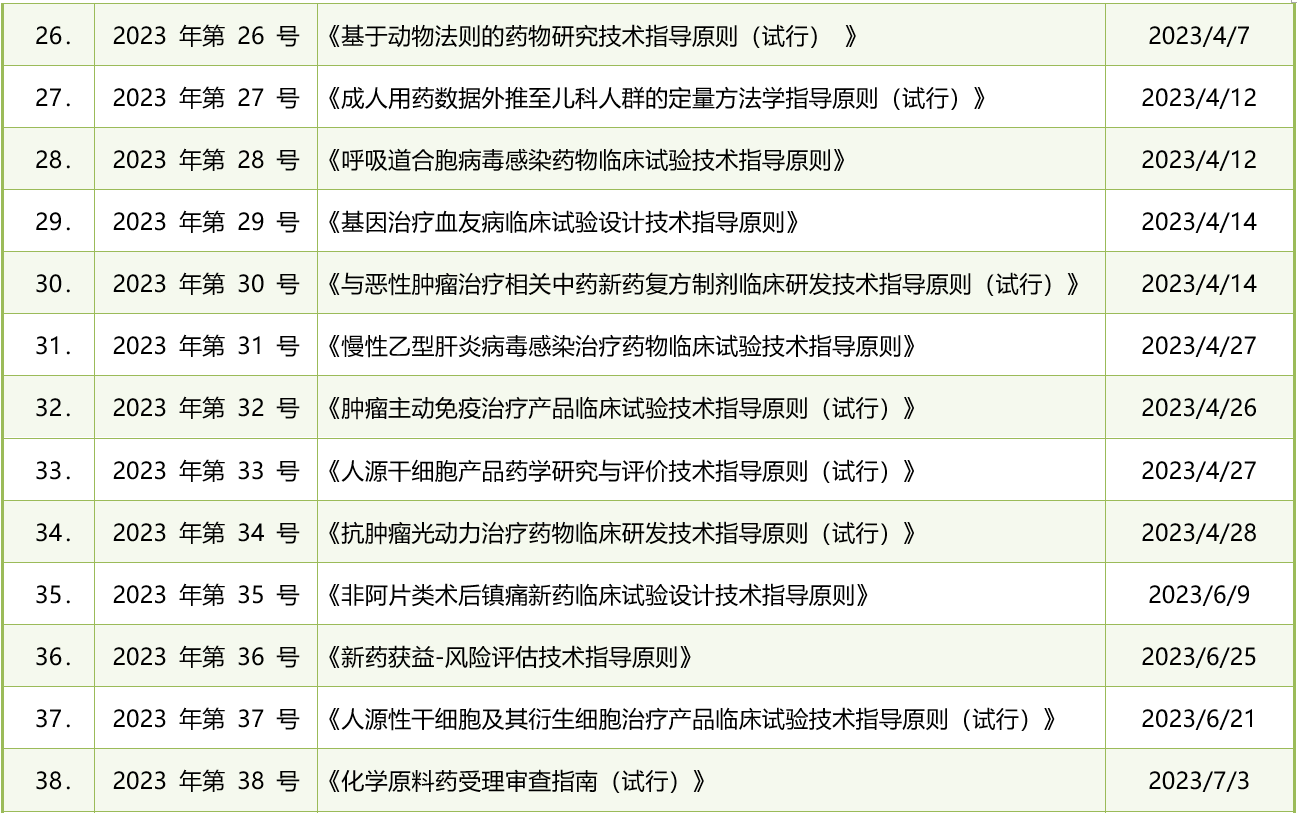
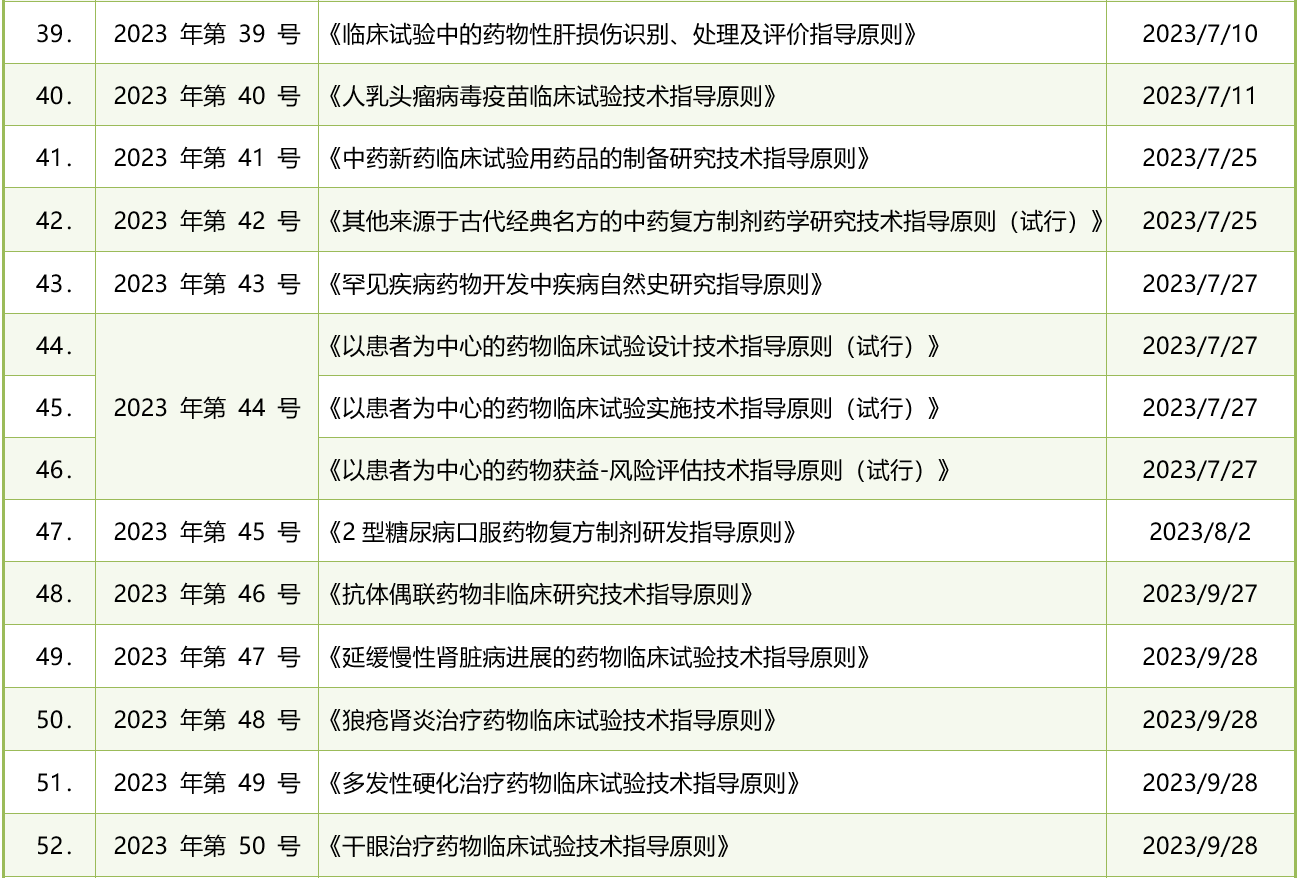
表1. 2023年CDE发布的药品注册法规政策清单 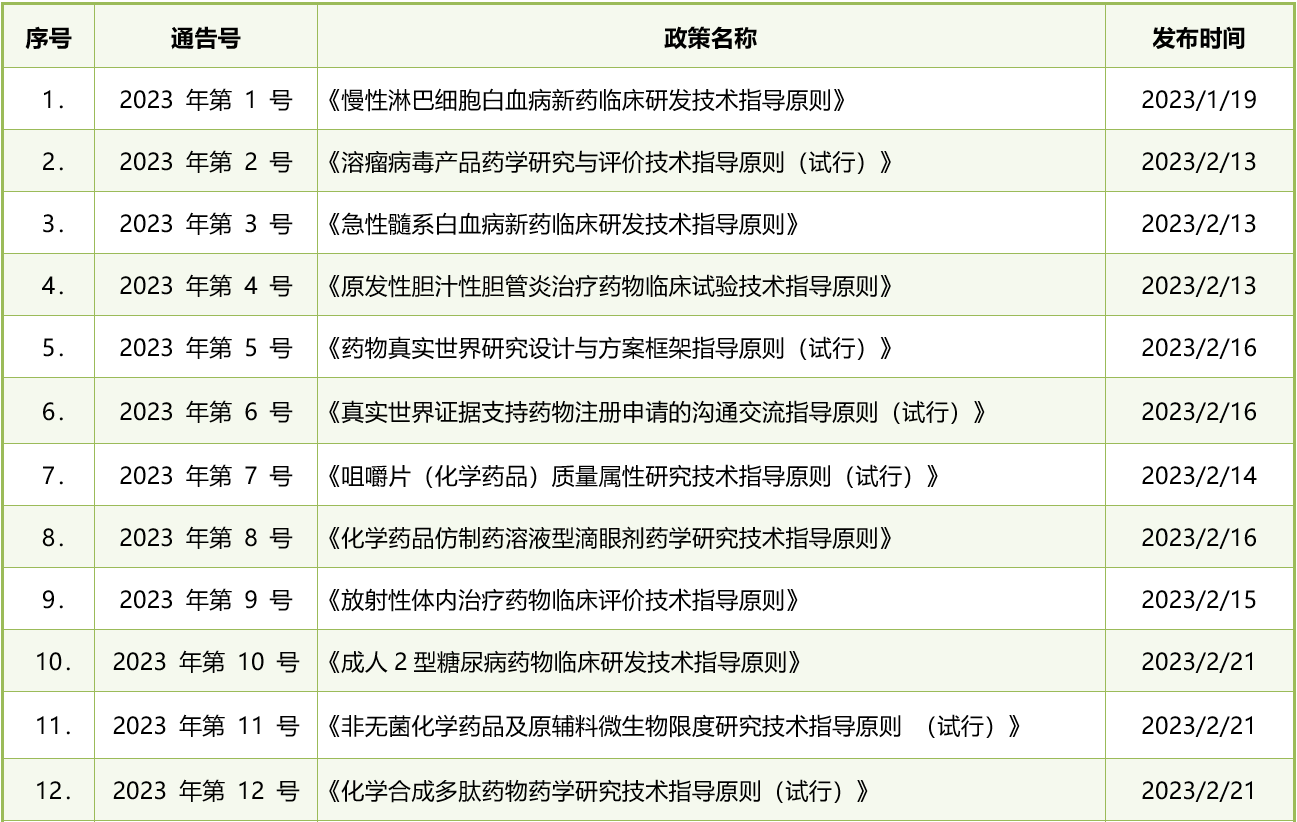
PART.
02
2023年CDE药品注册法规政策简要分析2023年度CDE发布药品注册相关法规政策共66份,内容横跨非临床、临床、生物统计和药学等多个关键领域。
- 具体来看,临床类指导原则占据最大比重,共有41项,为药品的临床试验设计、实施和数据分析提供了详尽的指南;
- 药学类指导原则紧随其后,共有17项,为药品的药学研究、质量控制和稳定性评估等提供了标准。
- 此外,非临床类指导原则3项、生物统计类3项、注册类2项,共同构成了药品研发和生产的全流程指导体系。
这些指导原则的发布,为中国药品的研发、生产和审评提供了更加明确和规范的指导。详见下图:
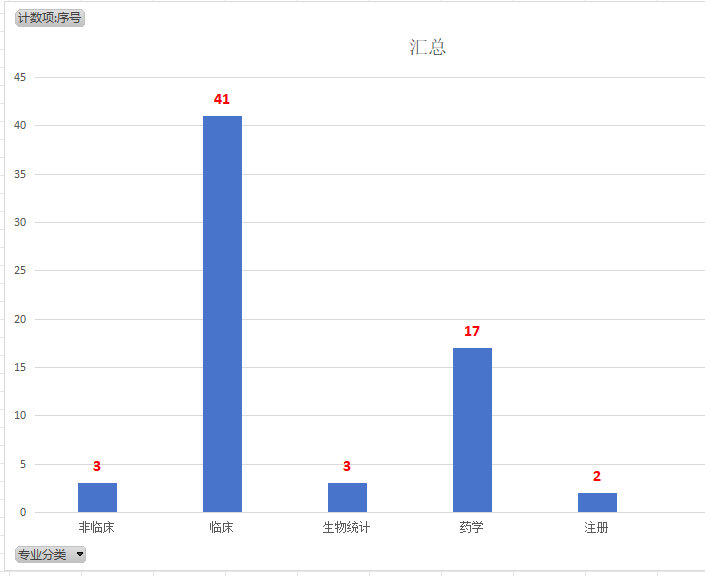
图1. 2023年CDE药品注册相关法规政策领域构成柱状图
药品根据其性质和来源,被划分为化学药、生物制品和中药三大类别。每一类别都有其独特的研发、生产和审评要求,以确保药品的质量、安全性和有效性。我们看到了2023年度针对不同类别药品的注册相关法规政策的分布情况。
- 具体来说,化学药类则占据了最大比重,共计51项,这反映了化学药在药品市场中的重要地位及其研发的复杂性。
- 紧接着是生物制品类,共有45项指导原则,这体现了生物制品研发领域的专业性和规范性。
- 而中药类指导原则有15项,虽然数量相对较少,但也足以表明对中药研发和生产的关注和重视。
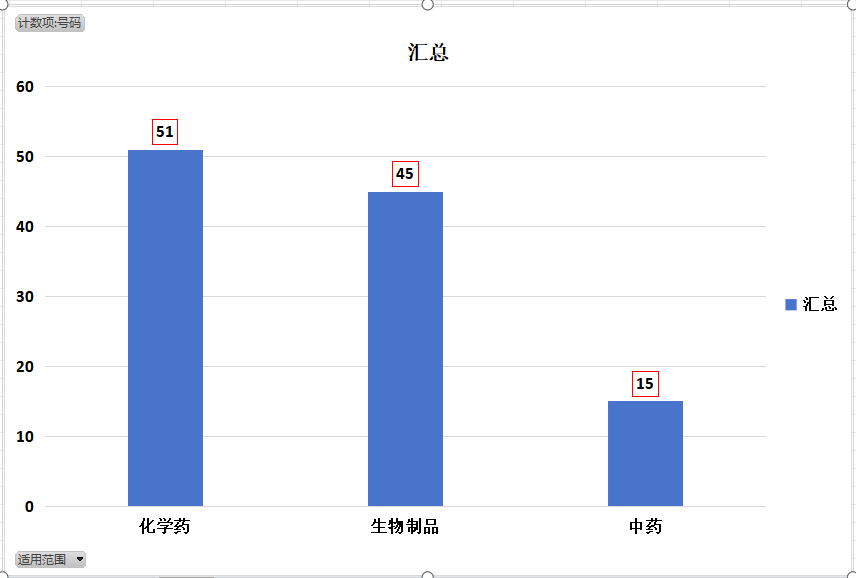
图2. 2023年CDE药品注册相关法规政策药品类别构成柱状图
值得注意的是,部分指导原则具有普遍性,它们不仅适用于生物制品,也适用于化学药品和中药等多个类别的药品。这意味着无论药品属于哪一个类别,都需要遵循这些通用的技术指导原则,以确保药品在整个研发、生产和审评过程中的质量、安全性和有效性。 PART.
03
小结与展望随着2023年CDE药品注册法规的新变化,药企面临挑战与机遇。新政策下,技术指导原则对研发、临床试验和上市数据的要求更严格。这既体现国家对质量安全的重视,也意味着创新药研发进入“提质”时代。企业需适应变革,进行战略布局。
首先,企业要学习理解新政策,确保药品研发策略合规,提升竞争力。同时,需加强研发实力,适应审评标准提升。
其次,企业应增加研发投入,提高技术水平,满足政策要求。
再者,企业要拓展国际市场,增强品牌国际影响力,参与国际认证,提升研发和产品质量,扩大市场份额。
总之,面对医药注册审评相关政策变化,企业要积极应对,通过学习、投入、优化流程和国际化等措施,提升研发和产品质量,实现可持续发展。 参考资料:
[1] www.cde.org.cn






