低浓度阿托品研发攻坚时刻,或将改写近视治疗市场格局。
10月13日,兆科眼科宣布,NVK002(0.01%低剂量阿托品)为期一年的3期小型CHAMP临床试验的顶线结果,拟申报上市。据悉,NVK002是一种用于控制儿童及青少年近视加深的试验性新型外用眼部溶液,其所拥有的配方能够解决低浓度阿托品的不稳性,且产品不含防腐剂,预计保存期至少为24个月。

消息一经公布,极大吸引了行业目光。长期以来,市场对于低浓度阿托品控制近视有着积极的市场预期。但是,由于国内还没有正式获批低浓度阿托品滴眼液,未来兆科眼科NVK002研发顺利成功上市,很可能在国内眼科市场掀起新的旋风。
实际上,由于框架眼镜、角膜接触镜、手术矫正等近视矫正及预防措施更新迭代,此前眼科近视领域多以器械、耗材占主导。随着创新药物不断发展,眼科药物也出现了越来越多的机会。
业内人士表示,眼科药物市场尚是一片蓝海。以阿托品为代表的眼科药物正在虎视眈眈器械为主导的近视市场。目前,已有越来越多眼科企业近年来争相布局此产品,目前赛道入局者不在少数,包括恒瑞医药、兴齐眼科、欧康维视、参天制药、齐鲁制药和极目生物等。眼科药物研发即将进入爆发期,千亿近视市场谁拔头筹?
近视药物研发迎转折
兆科眼科蓄力冲刺
过高的患病率,使得近视问题成为我国青少年健康成长过程中的一大难题,青少年近视的防控工作已经到了刻不容缓。在相关药物研发过程中,低浓度阿托品一直吸引着研发者的热情。
不过,低浓度阿托品的药物研发存在一定挑战。实验发现,阿托品在低浓度下并不稳定,意味着它的保质期不会很长,这给低浓度阿托品滴眼液的使用和研发上市带来了巨大困难。
在此情况下,一款低浓度的阿托品眼药水NVK002被业内关注到,其能成功解决低浓度阿托品的不稳性。据悉,NVK002由拥有丰富的眼科及可注射产品组合的Nevakar公司负责开发研究。2020年10月,兆科眼科与Nevakar公司(Nevakar公司已将协议转让予其全资附属公司Vyluma公司)订立许可协议,获得NVK002在大中华区、韩国、东南亚若干国家等地的开发和商业化权利。
10月13日,兆科眼科宣布NVK002为期一年的3期小型CHAMP临床试验的顶线结果。经过一年的治疗,这项多中心的研究分析表明,NVK002作为一种治疗儿童近视加深的潜在疗法具有强健的安全性和有效性,并与该公司合作伙伴Vyluma所进行的3期CHAMP临床研究首年的趋势吻合。
此次取得积极结果的3期小型CHAMP临床试验是一项随机、双盲、安慰剂对照、多中心的临床研究,主要目的是评估NVK002对延缓中国儿童和青少年近视加深的有效性和安全性。该临床试验涉及16个中心,入组526名儿童和青少年,由复旦大学附属眼耳鼻喉科医院瞿小妹教授和中山大学中山眼科中心杨晓教授共同担任牵头研究者。
结果显示,试验达到主要疗效终点。与使用安慰剂相比,0.01%及0.02%剂量的NVK002对减缓研究对象近视加深均表现出统计学及临床意义方面的差异。NVK002在两个剂量上均表现出良好的耐受性及安全性,分别从较低的治疗中断率及眼部严重不良事件发生率两项可见一斑。
在此公告发布的前一天,Vyluma公司宣布NVK002在3期CHAMP临床研究的第二阶段取得积极的顶线结果。研究结果表明,在四年的治疗和随访后,NVK002作为治疗儿童近视的潜在治疗方案具有持续的强劲安全性和疗效,研究药物洗脱后没有反弹。这款眼药水疗法目前正在接受美国FDA的审评,预计在明年1月31日之前得到审评结果。兆科眼科也在计划与监管机构沟通,结合小型CHAMP研究结果和Vyluma公司的3期CHAMP研究数据,推进NVK002在中国的新药上市申请进度。
除了为期一年的小型CHAMP研究外,兆科眼科还进行了另一项并行的为期两年的3期临床试验。这项试验涉及18个中心,招募了777名患者。患者入组于2022年7月21日完成。
不过,药品研发并非一帆风顺之事,资本市场认可与否同样难以准确捉摸。在兆科眼科发布公告不久,其公司股价并没有迎来强势表现,仅在稍有微涨后便开始下跌,盘中下挫跌超8%,截至今日,股市仍然未见回转。
投资者分析认为,股价走势也反映出市场对于利好消息的价值分歧,或许和兆科眼科近期主动撤回干眼症药物叠加利空有关。前不久,兆科眼科主动撤回了另一款药物,用于治疗干眼症环孢素A眼凝胶的药品注册申请(NDA)。公告表示,就这一申请的最新进展,经过与监管机构的多轮沟通,公司认为需花费更多时间以充分回答CDE提出的额外问题,预期将超过补充资料法定提交的时限。
显然,面对资本寒冬考验,投资者已经变得更谨慎了。药物研发的道路一波三折,未达终点前,谁也不敢轻易断言成败。业内人士表示,NVK002的积极数据给业内带来极大振奋,减缓近视进展的创新药物研发又向前迈进了一步,期待改写近视治疗当前的局面,而产品本身的研发进展情况,需要理性评估创新与风险。
眼科市场空间正打开
国内低浓度阿托品竞争加剧
据中金公司测算,2030年近视防控市场规模有望达约2100亿元,十年复合增速约13.7%。预计2030年屈光、白内障手术市场规模均有望达1000亿元,十年复合增速分别达到21.4%、15.6%。
过去眼科市场以器械耗材为主。对于药物研发企业来说,不论是做戴角膜塑形镜(OK镜),还是做手术的,乃至配普通近视镜的企业体量都是庞然大物。爱尔眼科、爱博医疗、欧普康视、昊海生科等几家行业巨头2021年、2022年、2023年净利润增速均让人“眼馋”。
因此,国内居高不下的近视率增加了对眼科药品的需求,庞大的市场规模也催生出近视药物的研发。低浓度阿托品的出现与爆火将对原本的眼科市场产生冲击,研发相关药物的企业势必要分得一块大蛋糕。
除兆科眼科外,低浓度阿托品滴眼液的药物临床试验已有多家处于三期临床节点及以后,包括兴齐眼药、欧康维视、参天制药、恒瑞医药、齐鲁制药和极目生物等。
在低浓度阿托品的研发过程中,与兆科眼科一样搅动市场风云的还有前文提到的兴齐眼药。早在2016年,兴齐就拿下了新加坡国立眼科独立授权,获得阿托品滴眼液5年的临床研究数据,共同开发硫酸阿托品滴眼液实验研究,不过,此前兴齐眼药因“院内制剂”运作模式引发了市场争议,也进一步让兴齐眼药审慎思考规范的运营路径。
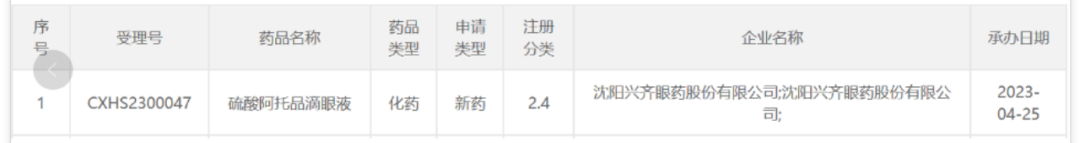
在跟进相关研发方面,兴齐眼药也开始加速。4月25日,CDE官网最新公示,兴齐眼药递交了硫酸阿托品滴眼液的新药上市申请并获得受理。根据兴齐眼药公告,该产品是以硫酸阿托品为活性成分的眼用制剂(SQ-729),此次申报适应症:用于延缓儿童近视进展。
在兴齐眼药、兆科眼科与“低浓度阿托品”上你追我赶的同时,国内也有创新药企盯上了这个赛道:
恒瑞医药在2021年9月登记了III期临床,治疗周期为144周(3年),主要终点在内的多个临床终点设置在96周和48周(暂记为2年期研究),目前也已完成患者入组。参考兆科的进度计划,预计恒瑞可能在2024年第二季度或第三季度完成临床患者出组;
参天制药2年期临床也已经完成患者入组,临床登记时间上落后兆科、恒瑞4~6个月,预计会24Q4前后完成临床;
欧康维视也在今年6月份完成了III期国际多中心临床患者入组(2月份完成中国区入组),因为是全球性临床试验,设计了3+1的研究周期,临床结束预计要到2026H2或者2027年。
......
行业专家分析认为,目前兴齐眼药已经进入上市申报阶段,具备一定程度的领先优势;恒瑞、兆科眼科开发进度相近,但是,兆科眼科先一步公布NVK-002积极数据,如果能够用桥接临床数据+海外数据申报,NDA将提前半年以上,这便有可能领先恒瑞,并缩短与兴齐的进度差距。谁将拔得头筹,值得期待。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx