1、海思科HSK21542注射液报产获受理
10月17日,CDE官网显示,海思科提交的HSK21542注射液的上市申请已被受理。

HSK21542是一款神经系统1类新药,属于强效外周Kappa受体激动剂。公开资料显示,海思科最早于2019年提交HSK21542注射液的1类新药临床申请,目前术后镇痛适应症的III期临床已完成,慢性肾脏疾病相关性瘙痒等适应症正在开展III期临床。
除这次报产的HSK21542注射液外,今年9月,海思科开发的口服制剂HSK21542片Ⅰ期临床试验也完成了首例受试者的入组和用药。本次Ⅰ期临床试验是为评估HSK21542片在健康受试者中的安全性、耐受性、药代动力学、绝对生物利用度以及食物对药代动力学影响。
2、泽璟制药ZG005粉针剂临床试验再获受理
10月17日,CDE官网显示,泽璟制药提交的ZG005粉针剂的临床申请已被受理。
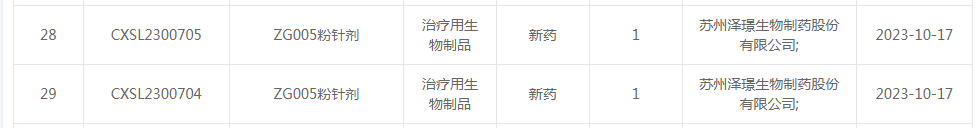
ZG005是重组人源化抗PD-1/TIGIT双特异性抗体粉针剂,为创新型肿瘤免疫治疗生物制品,注册分类为1类,有望用于治疗多种实体瘤。根据公开资料,ZG005是全球率先进入临床研究的同靶点药物之一,目前全球范围内尚未有同类机制药物获批上市。
今年9月,泽璟制药发布公告称,其收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,ZG005粉针剂与甲苯磺酸多纳非尼片(商品名:泽普生)联合用于实体肿瘤的临床试验获得批准。
3、恒瑞医药注射用SHR-A2009临床试验获受理
10月17日,恒瑞医药子公司苏州盛迪亚生物医药有限公司提交的注射用SHR-A2009临床试验补充申请获得受理。

SHR-A2009是恒瑞医药自主研发的一款以HER3为靶点的抗体药物偶联物,可特异性结合肿瘤细胞表面上的HER3,进而被内吞至细胞内并转运至溶酶体中,水解释放游离毒素,抑制DNA拓扑异构酶I的活性,杀伤肿瘤细胞。
今年7月,恒瑞医药发布公告称,其子公司上海盛迪医药有限公司和苏州盛迪亚生物医药有限公司收到国家药监局核准签发关于阿得贝利单抗注射液、注射用SHR-A2009的《药物临床试验批准通知书》,将于近期开展临床试验。
4、第一三共TLR7抗体在华申报临床,治疗红斑狼疮
10月16日,CDE官网显示已受理第一三共在华提交的TLR7抗体药DS-7011a的临床申请。

DS-7011a是一款TLR7抗体,用于治疗系统性红斑狼疮和皮肤性红斑狼疮,目前处于1b/2期临床中。2021年,第一三共公开抗TLR7抗体相关专利,研究显示嵌合抗人 TLR7 抗体以浓度依赖性方式抑制人 PBMC 产生IL-6。
系统性红斑狼疮(SLE)是一种慢性自身免疫性疾病,主要表现为免疫系统产生的自身抗体攻击患者自身组织,造成全身多脏器损伤。全球SLE患者超过300万人,在年轻女性群体中存在较高发病率。
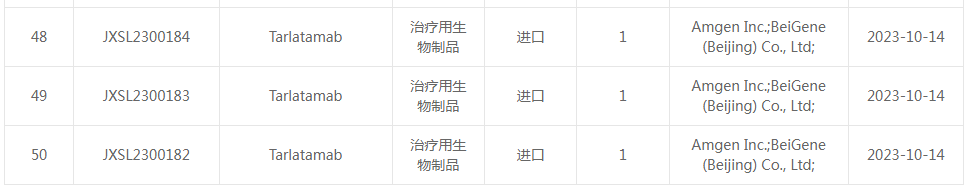
5、安进/百济神州DLL3/CD3双抗在华申报临床
10月14日,安进递交Tarlatamab的临床试验获得CDE受理。Tarlatamab(AMG 757)是一款半衰期延长的双特异性 T 细胞接合剂(HLE BiTE®),结合 DLL3 和 CD3形成细胞溶解突触,诱导 T 细胞活化和扩增以及 T 细胞依赖性肿瘤细胞杀伤,用于小细胞肺癌(SCLC)。
今年1月其发表了治疗复发SCLC的I期临床结果,中位随访时间8.7个月,主要终点为DLT, AE和TEAE。
在重度预处理的SCLC患者(n=106)中,确认ORR为23%(确认和未确认的反应),疾病控制率超一半(51%)
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx