8月21日,Geron Corporation宣布其潜在“first-in-class”端粒酶抑制剂Imetelstat用于治疗低危骨髓增生异常综合征(LR-MDS)患者的输血依赖性贫血的新药申请(NDA)获FDA受理。该公司预计在今年第四季度在欧盟提交Imetelstat的上市申请。Imetelstat是Geron Corporation成立以来首 款申报上市的产品,同是也是全球第一款申报上市的端粒酶抑制剂。
Imetelstat主要是以端粒酶RNA模板为靶点,竞争性抑制端粒酶活性。临床前实验与临床试验数据显示,Imetelstat通过靶向端粒酶来抑制髓性血液恶性肿瘤中恶性干细胞和祖细胞的不可控增殖,并导致癌细胞凋亡和潜在改变疾病进程。
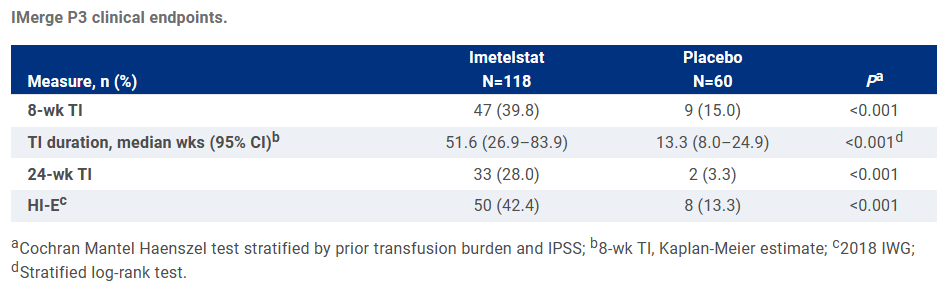
此次NDA主要是基于一项II/III期研究(IMerge)的积极结果。该研究共纳入178例非5号染色体长臂缺失、依赖输血的成人LR-MDS患者,这些患者在接受促红细胞生成素(ESA)治疗后疾病进展或者对ESA不耐受。试验组患者接受每4周1次7.5mg/kg Imetelstat治疗,对照组则接受安慰剂治疗。研究的主要终点为第8周无需输血的患者比例(即RBC-TI,红细胞输血独立率)。
结果显示,Imetelstat组患者无需输血的比例显著高于安慰剂组(39.8% vs. 15.0%;P<0.001),无需输血的时间亦更加持久(51.6 vs. 13.3周;P<0.001)。安全性方面,未报告新的安全信号,最常见的3-4级不良事件为血小板减少症和中性粒细胞减少症。Imetelstat组和安慰剂组发生3级出血和感染事件的比例相似。
多项研究结果显示,骨髓增殖性肿瘤(MPN)由于细胞过度增殖,导致端粒缩短,端粒酶活性上调,这为Imetelstat治疗MPN奠定了一定理论依据。目前,Imetelstat针对原发性血小板增多症(ET)和骨髓纤维化(MF)的治疗已显示出较好的临床前及临床活性,但对其应用于MPN治疗的有效性和安全性尚需要更多随机、多中心、大样本的临床试验数据以证实。
THIO:下一款重磅端粒药物?
端粒是真核生物染色体末端的DNA重复序列,能够保持染色体的完整性和控制细胞分裂周期。正常细胞每次染色体复制后,后随链上的染色体末端是无法被复制的,这会导致端粒的缩短。当端粒缩短到极限长度时,会诱导持续的DNA损伤反应导致基因组不稳定,从而引发细胞衰老或凋亡。
癌细胞与正常细胞的不同就在于其通过激活端粒维持机制(TMM)来延长端粒形成无限复制模式。与癌细胞不同的是,人体内除了部分干细胞群,正常的体细胞缺乏端粒维持机制,基本>85%的人类癌症中均存在端粒酶,端粒酶对癌细胞的增殖和生殖永生有重大贡献。因此靶向端粒维持一直是研究治疗绝大多数癌症的一个方向,但端粒酶抑制剂在过往研发中又极具挑战,至今没有相关药物上市。
除了此次申报上市的Imetelstat,还有一款在研的端粒药物THIO同样值得关注。6-THIO-2'-脱氧鸟苷是一种端粒酶底物前体核苷类似物,容易通过端粒酶掺入新合成的端粒中。THIO,又名6-硫代-dG,6-硫代-2'-脱氧鸟苷,是一种由MAIA公司研发的潜在同类首 创小分子,是目前临床开发中唯一的直接于端粒的靶向药。
THIO作为一种端粒靶向药,被端粒酶识别并掺入癌细胞的端粒中,THIO会损害端粒结构和功能,导致染色体末端“解封”,从而导致肿瘤细胞快速死亡;与其他直接端粒酶抑制剂相比,THIO导致DNA损伤优先定位在端粒中,从而迅速导致端粒酶阳性肿瘤细胞中的细胞死亡,但不会导致端粒酶无活性的正常细胞死亡。根据 THIO 对肝细胞癌 (HCC) 和小细胞肺癌 (SCLC) 的临床前疗效,FDA 已授予 2 个孤儿药称号。
体内临床前模型显示,低剂量的THIO联合抗PD-L1或抗PD1治疗,在结直肠癌、肝 脏和小细胞肺癌模型中获得了令人鼓舞的结果:可完全消除晚期肿瘤,并产生了癌细胞特异性免疫记忆,其中免疫系统在长时间后继续对癌细胞具有活性,无需额外治疗。
MAIA公司近期宣布正在进行的THIO-101 II期试验A部分安全性导入期的疾病控制数据,该研究评价THIO序贯联合cemiplimab(PD-1抑制剂)治疗晚期NSCLC患者。在入组THIO-101并完成至少1次基线后缓解评估的前11例患者中,9例(82%)达到疾病控制的主要终点。所有入组患者既往接受过2线或2线以上治疗失败,包括免疫检查点抑制剂和含铂化疗。此时未进行新的安全性分析。
MAIA公司即将进行一项多中心、开放标签的2期临床试验THIO-102,旨在评估THIO与抗PD-1(帕博利珠单抗)或抗PD-L1(阿替利珠单抗)药物的依次给药组合对于端粒酶阳性的肿瘤患者的安全性和疗效。按照创新的篮式(basket)/伞式(umbrella)试验设计,该试验分为四个小组,包括小细胞肺癌、肝癌、结直肠癌和所有类型的实体瘤。第一个分组旨在评估THIO作为小细胞肺癌的一线治疗的效果,即将THIO加入到目前的标准治疗中。在其他的队列中,MAIA公司计划评估THIO与阿替利珠单抗或帕博利珠单抗的依次给药组合,目的是在A部分试验中按肿瘤类型选择出最 佳治疗组合,并扩展到B部分研究;B部分试验包括了多个关键性研究臂,以寻求加速批准。THIO-102试验有望为THIO提供超过9个额外的适应症, 加上现有的非小细胞肺癌试验是另一个适应症,有可能使THIO总共获得超过10个适应症。
参考来源
1.https://ir.maiabiotech.com/news-events/press-releases/detail/71/maia-biotechnology-reports-updates-on-disease-control-rates
2.ADDING MULTIMEDIA: MAIA Biotechnology’s Telomere-targeting Agent THIO, in Combination With Checkpoint Inhibitor Immune Therapies Atezolizumab (anti-PD-L1) or Pembrolizumab (anti-PD-1), Demonstrated Significantly Greater Tumor Inhibition,Retrieved Feb 14th, 2023, from https://www.businesswire.com/news/home/20230213005224/en/
3.https://www.onclive.com/view/thio-followed-by-cemiplimab-shows-early-promise-in-advanced-nsclc
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx