PI3K的研发道路曲折漫长,一波三折,很多上市的药物都撤销了适应症,如吉利德的Idelalisib,Secura Bio的Duvelisib和TG Therapeutics的Umbralisib,不仅如此,拜耳Copanlisib在欧盟用于治疗边缘区淋巴瘤(MZL)和TG Therapeutics的Umbralisib用于治疗慢性淋巴细胞白血病(CLL)的新药申请都被拒绝。
PI3K药物研发一时乌云笼罩,不过也有好消息,诺华研发的PI3Kα抑制剂Alpelisib探索新适应症,成功获批乳腺癌适应症,后又于去年获批治疗PIK3CA相关过度生长疾病谱系(PROS)成人和2岁及以上儿童患者的新适应症,得益于此,Alpelisib的销售额稳步上升,2021年销售额达到3.29亿美元,今年上半年销售额已经达到2.46亿美元,大幅度增加。
近期,林普利塞拟纳入优先审评,用于既往接受过一线充分治疗的复发和/或难治性外周T/NK细胞淋巴瘤成人患者。林普利塞是由璎黎/恒瑞开发的首 个国产自主研发获批的PI3Kδ抑制剂,曾于去年11月获NMPA附条件批准,用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤(FL)成人患者。
目前PI3K药物的研发竞争还是很激烈,国内外很多药企从事于PI3K药物开发,如罗氏、诺华、吉利德和百济等,开发的类型多样,包括pan-PI3K抑制剂,亚型特异性选择抑制剂和靶向突变位点的抑制剂。
其中靶向PI3Kα H1047R药物LOXO-783、RLY-2608和STX-478等值得关注,不过RLY-2608披露的临床数据也给大家浇了盆冷水,临床疗效达不到终点,但是毒 性确实比靶向野生型PI3K的抑制剂小,LOXO-783和STX-478还在临床试验中,后续的开发需密切关注安全性问题。
PI3K家族和信号通路a
磷脂酰肌醇 3-激酶(PI3K)是一种胞内脂质磷酸激酶,主要是在磷脂酰肌醇(phosphatidylinositide,Ptdlns)3’端的羟基上加上磷酸。已经发现了三类PI3K,即I类,II类和III类,除了常见的底物Akt(图1)外,每种PI3Ks都有特定的底物和不同的效应器(图1)[1]。
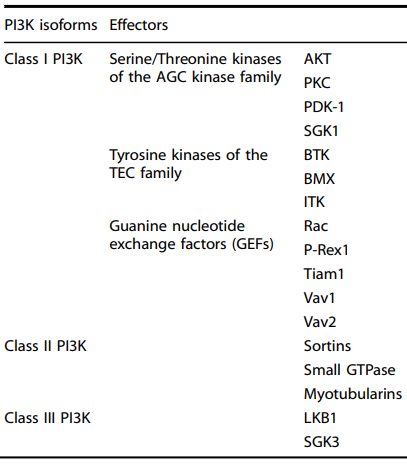
图1. I、II 和 III 类 PI3K 的不同效应器
I类PI3K含有四种催化亚型,p110α,p110β,p110γ和p110δ,它们分别由PIK3CA、PIK3CB、PIK3CG和PIK3CD编码。在四种I类催化亚型中,PIK3CA由于其频繁的突变在人类癌症中普遍被提及,如在胃癌(36.4%)、甲状腺癌(30%)、前列腺癌(28%)、卵巢癌(13.3-29.8%)、宫颈癌(9.1-76.4%)和其他癌症中经常扩增。
I类PI3K由 p110 催化亚基和 p85 调节亚基组成的异二聚体通过激活下游酪氨酸激酶如 G 蛋白偶联受体(GPCR)和小单体GTP酶发挥其功能。此外,p85亚基可以通过下游蛋白质的活化来传递各种细胞信号(图2)[1]。
II类PI3K包括C2α、C2β和C2γ催化亚型和缺乏调节亚基,因此,它们可以作为单体被活化。在哺乳动物中,已经鉴定出三种II类PI3K亚型,其中PI3KC2α和PI3KC2β广泛表达,而PI3KC2γ主要在肝 脏中表达。
III类PI3K VPS34(也称为PIK3C3)是独特的,因为它通过与由调节亚基和催化亚基组成的蛋白质复合物结合调节其在自噬和巨噬细胞吞噬作用,因此,异源二聚体III类PI3K也可以调节自噬。
PI3K/Akt通路在各种细胞过程中起至关重要的作用,并在癌症中异常激活,导致肿瘤的发生和发展,具体情况如下(图2)。
一方面,配体与特定的RTK(EGFR,VEGFR和FGFR)相结合可以通过RAS激活I类PI3K;另一方面,I 类 PI3K 可以通过 B 细胞适配器和 GPCR 由 BCR 激活。FGFR底物FRS2与GRB2,SOS和GAB1结合磷酸化以激活I类PI3K。除了被EGFR激活外,II 类 PI3K 可以通过 TCR 激活。当III类PI3K被氨基酸激活时,活化的PI3K磷酸化PIP2肌醇头的第三个碳并将其转化为PIP3,从而通过PDK1和RAC激活AKT,PTEN可以抑制这种转化过程。此外,I GF-1与IGF1R联合可以招募IRS-1和I类PI3K,然后参与PIP2向PIP3的转化(图2)。
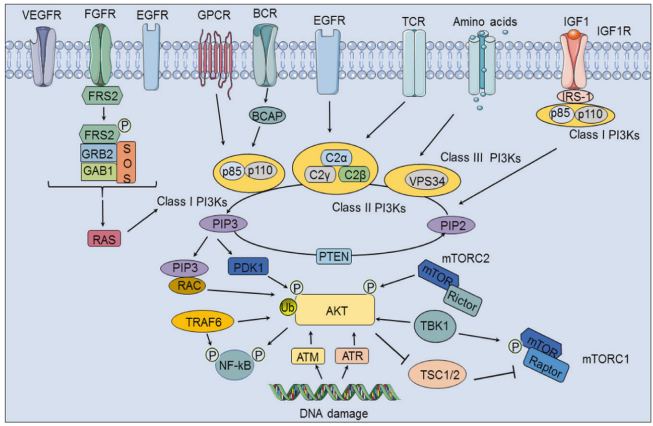
图2. PI3K/Akt 信号通路的激活
获批上市的PI3K抑制剂
目前,研究人员开发的PI3K抑制剂种类很多,根据作用机制,大致可分为广谱型PI3K抑制剂(pan-PI3K)、亚型特异性PI3K抑制剂和靶向PI3K/mTOR双重抑制剂三大类。
PI3Kδ是目前已上市的用于治疗恶性血液病的PI3K抑制剂最常用的治疗靶点,因为PI3Kδ主要存在于白细胞中,在多种B细胞淋巴瘤中处于活化状态以及在调节适应性免疫系统细胞(B细胞和部分T细胞)以及先天免疫系统(中性粒细胞、肥大细胞和巨噬细胞)中具有重要作用,所以之前被认为是治疗血液系统恶性肿瘤的理想靶点之一。
全球总共批准5款PI3K抑制剂,包括吉利德的Idelalisib(Zydelig)、拜耳的Copanlisib(Aliqopa)、Secura Bio的Duvelisib(Copiktra)、诺华的Alpelisib(BYL719,Piqray)、TG therapeutics的Umbralisib和璎黎的林普利塞片(因他瑞),除了诺华的Alpelisib是抑制剂PI3Ka,大部分都是抑制PI3Kδ(图3)。
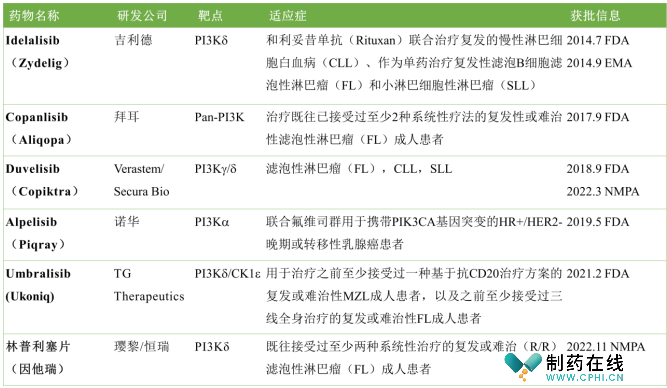
图3. 获批上市的5款PI3K抑制剂信息
然而上市的药物由于安全性问题被大规模撤回适应症。2021年Secura Bio 撤销了duvelisib 复发性或难治性FL的适应症,2022年6月30日,FDA再一次对duvelisib可能会增加慢性血癌(CLL/SLL)患者的死亡和严重副作用风险发出安全性警告,同年9月23日,FDA召开审议duvelisib与奥法木单抗(ofatumumab)治疗复发性/难治性CLL/SLL的5年对照试验DUO数据的会议。
结果表明与奥法木单抗相比,duvelisib完全不仅没有总生存期(OS)优势,还明显出现了更高的毒 性(图4)[2]。因此,FDA肿瘤药物咨询委员会以8:4的投票结果,反对批准Duvelisib三线治疗CLL/ SLL的适应证,这几乎等同于建议Duvelisib退出美国市场。
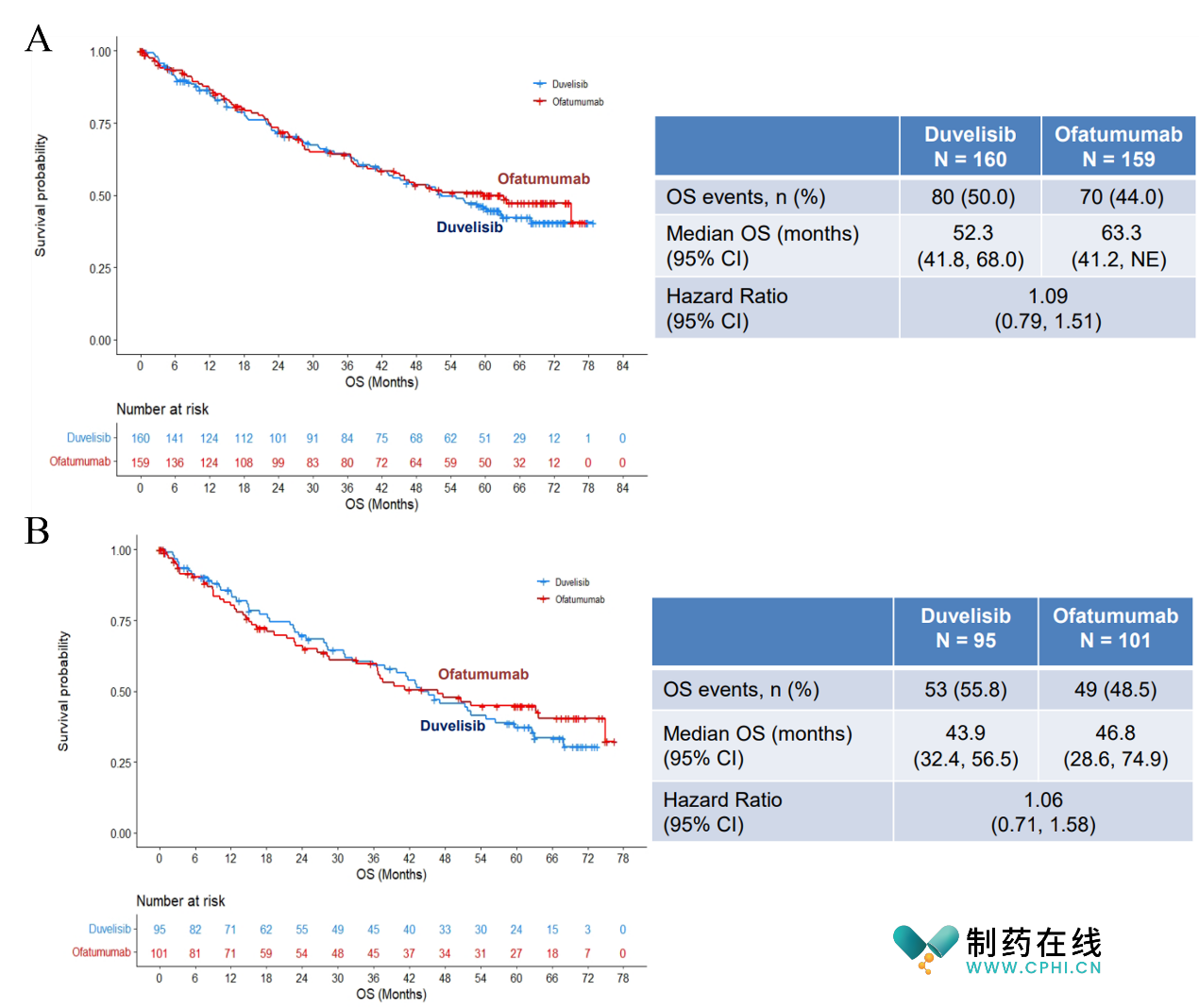
图4. duvelisib与奥法木单抗临床试验数据
除了duvelisib之外, 2022年1月14日,吉利德的Idelalisib也从美国被撤销了2个适应症FL和SLL。去年TG therapeutics也撤回了Umbralisib的滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)适应症。
不仅如此,还有一些新药上市申请也被拒绝,如拜耳的Copanlisib(Aliqopa)在欧盟用于治疗边缘区淋巴瘤(MZL)的上市申请被拒绝,FDA拒绝了TG Therapeutics的Umbralisib慢性淋巴细胞白血病(CLL)新药申请的批准(图5)[2]。

图5. 被FDA撤回适应症和被NDA拒绝申请的PI3K药物
国内目前只有石药集团从Verastem引进的PI3Kδ/γ双重抑制剂度维利塞胶囊(Duvelisib)和璎黎/恒瑞的林普利塞片上市。
林普利塞是由璎黎研发的PI3Kδ抑制剂,结构如图6所示,2021年2月8 日,恒瑞医药对璎黎药业进行2000万美元股权投资(占总股本6.67%),并获得了林普利塞在大中华地区的联合开发权益以及排他性独家商业化权益。林普利塞于2022年11月获NMPA附条件批准,用于既往接受过至少两种系统性治疗的复发或难治FL成人患者,成为首 个国产上市的PI3Kδ抑制剂。
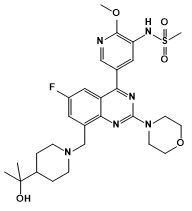
图6. 林普利塞结构
8月15日, CDE 官网显示林普利塞拟纳入优先审评,用于既往接受过一线充分治疗的复发和/或难治性外周 T/NK 细胞淋巴瘤成人患者。
去年欧洲血液学协会(EHA)年会公布了林普利塞治疗R/R FL患者的中国2期临床试验最新数据:患者总缓解率(ORR)为79.8%,中位PFS为13.4个月,中位缓解持续时间(DOR)为12.3个月,疾病控制率(DCR)96.6%,12个月OS率为91.4%。
今年1月13日,林普利塞片正式进入临床应用,由哈尔滨血液病肿瘤研究所马军教授和苏州大学附属第一医院吴德沛教授开出首批处方,零售价格为22800元人民币/120粒/20mg/盒。
其它在研的PI3K抑制剂
尽管如此,PI3K的研发竞争还是很厉害,不少大药企仍然在开发PI3K抑制剂,如诺华、罗氏、安进和阿斯利康等,国内也有很多药企在开发PI3K的抑制剂如百济神州和信达等(图7)。
但是如前面所示,PI3K药物开发困难重重,即使上市了都有可能因为毒 性问题被撤适应症,其它新药的研发也遇到种种困难,去年2月份,Incyte公司向FDA撤回了parsaclisib针对FL、MZL和套细胞淋巴瘤(MCL)的新药上市申请(NDA),随后3月份,FDA拒绝了MEI Pharma的zandelisib上市申请,临床上也有很多PI3K抑制剂被终止,如Pilaralisib(XL147)、Sonolisib(PX-866)和SAR260301等。
Parsaclisib是由美国Incyte研发的靶向PI3Kδ的新型口服抑制剂,对于抑制PI3Kδ在恶性B细胞淋巴瘤的生长、存活中起到重要作用。在临床前研究中,它展现出的高选择性和有效性的数据使其有潜力为淋巴瘤及其它恶性血液肿瘤患者提供临床获益。2018年底,信达生物制药和Incyte达成战略合作和独家开发协议,信达生物以高达约3.9亿美元(含4000万美元首付款)的总金额引进了pemigatinib(FGFR1/2/3抑制剂)、itacitinib(JAK1抑制剂)及parsaclisib(PI3Kδ抑制剂)三款产品。
2022年10月25日,帕萨利司片(parsaclisib,IBI376)在中国首次申报上市,随后11月,parsaclisib被CDE纳入优先审评,用于既往接受过至少两种系统性治疗的复发或难治性FL成人患者。2023年1月6日,parsaclisib的新药上市申请获得CDE受理。此次NDA受理基于parsaclisib的一项在中国开展的II期临床(NCT04298879)研究结果:在既往接受过至少两种系统性治疗的FL患者(n=61)中,客观缓解率(ORR)为86.9%,完全缓解率(CR)为31.1%,部分缓解(PR)率为55.7%。中位缓解持续时间(DOR)和中位无进展生存期(PFS)尚未达到。
然而今年4月份Incyte公司宣布缩减其研发管线,共终止6项研究,其中包括结束parsaclisib针对温抗体型自身免疫溶血性贫血的3期研究。

图7. 部分临床在研的PI3K药物
PI3Kα H1047R变构抑制剂
上市的5款PI3K药物中只有诺华的Alpelisib(Piqray)是靶向PI3K,于2019年5月24日被FDA批准上市,与氟维司群联合用于激素受体(HR)阳性,人表皮生长因子受体2(HER2)阴性,PIK3CA突变,晚期或转移性乳腺癌绝经后女性和男性。
2022年4月6日,alpelisib被FDA批准新的适应症,用于治疗需要接受系统治疗的PIK3CA相关过度生长疾病谱系(PROS)成人和2岁及以上儿童患者,成为首 个被FDA批准的PROS治疗药物。
不同于其它PI3K抑制剂,Alpelisib获批之后销量不错,2020销售额突破3亿美元,得益于PROS适应症的获批,2023年第一季度销售额达到1.16亿美元,同比增长61%,第二季度销售额达到1.3亿美元,同比增长54%。
Alpelisib的表现振奋人心,基于此,很多药企开发选择性PI3Ka抑制剂,如罗氏的Inavolisib和Petra Pharm的Serabelisib等。
PI3Kα是一种异二聚体,由催化亚基p110α和调节亚基p85α组成,催化亚基p110α在癌症中经常发生突变,主要包括E542K、E545K和H1047R,很多药企开始研发靶向PI3Kα突变位点的选择性抑制剂,如礼来的LOXO-783、Relay Therapeutics的RLY-2608和Scorpion的STX-478等(图8)[3]。
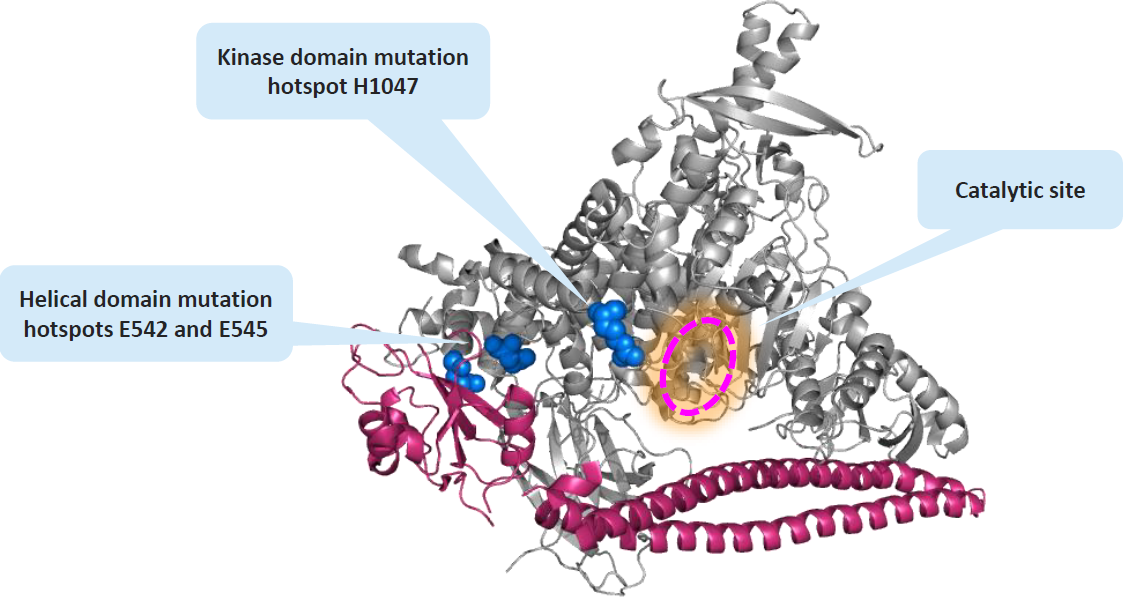
图8. PI3Ka结构以及突变位点
LOXO-783是礼来研发的靶向PI3Kα H1047R突变位点的变构抑制剂,也是礼来非常重视的一款早期研发管线,它是一种强效、高度突变选择性和可入脑的化合物,不抑制野生型PI3Kα、其他PI3K亚型或其他激酶。
目前LOXO-783正在进行两项Ia/Ib 期研究(NCT05894928和NCT05307705),用于治疗 PIK3CA H1047R 突变的晚期乳腺癌和其他实体瘤患者的疗效和安全性,今年2月份,礼来报道了LOXO-783与标准治疗(SOC)在临床前乳腺癌模型中的疗效的数据结果(PIKASSO-01试验,NCT05307705):LOXO-783结合SOC治疗在含有PI3Kα H1047R(单突变或双突变)的HR+ 和三阴性乳腺癌显示出协同的抗肿瘤功效(图9)[4]。
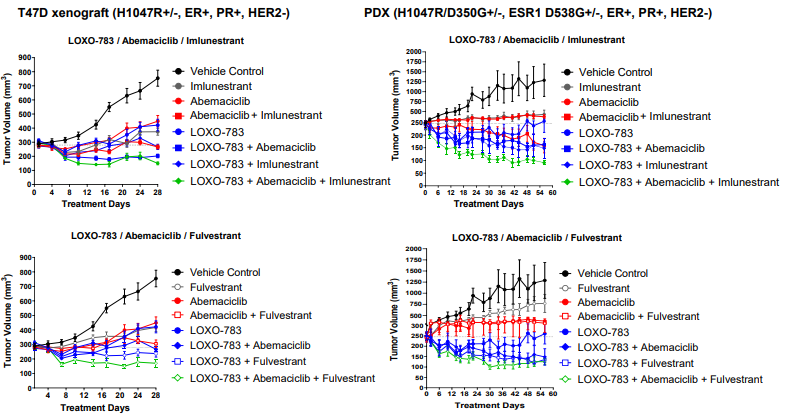
图9. LOXO-783与SOC治疗联用结果
去年 11 月被NMPA批准临床(受理号:JXHL2200238),成为国内个获批临床的PI3Kα H1047X 变构抑制剂。
RLY-2608是由Relay Therapeutics研发的一款靶向PI3Kα H1047R突变位点的变构抑制剂,对野生型PI3Kα活性很弱。但是今年披露的一项一期临床中期数据显示16例可评估疗效的患者中,9例(56%)的患者肿瘤缩小,仅1例患者达到unconfirmed PR,首次消息影响,Relay的股价一天跌掉36%,创历史新低。不过RLY-2608相比于其他非选择性PI3Kα抑制剂来说安全性优势更为明显,由于副作用导致alpelisib停药的17例患者中,接受RLY-2608治疗后都没有出现3级及以上副作用。
STX-478是由Scorpion基于Drug-hunting platform发现靶向PI3Kα H1047R突变位点的变构抑制剂,使小分子特异性靶向PI3Kα突变体,避免脱靶产生的代谢副作用。STX-478对PI3Kα H1047R的选择性超PI3Kα野生型14倍(IC50:11 nMvs146 nM),STX-478具备适当的CNS渗透性可治疗脑肿瘤,较长的半衰期和最小的峰谷血药浓度支持每日一次的给药并达到良好的治疗指数。
今年5月份,Scorpion Therapeutics宣布STX-478的1/2期临床试验中首次给药,1/2期临床试验将评估STX-478作为多种实体瘤的单一疗法,包括乳腺癌和妇科癌症、头颈部鳞状细胞癌(HNSCC)等,以及单一疗法和与批准的药物联合用于HR+/HER2-乳腺癌患者。Scorpion公司预计将在2024年公布初步的安全性、药代动力学和药效学结果,包括STX-478对提示抗肿瘤活性的潜在生物标志物的影响的数据[5]。
小结
PI3K基因扩增发生在很多肿瘤中,是一个有前景的肿瘤靶点,目前已获批上市5款药物,除了诺华的alpelisib的靶向PI3Kα,其它的都靶向PI3Kδ。
但是近几年由于安全性问题很多PI3K上市药物的适应症被撤回,不仅如此,还有一些药物的上市申请也被拒绝,一时间使得PI3K药物研发乌云笼罩。然而诺华的alpelisib逆势而为,不仅获批乳腺癌适应症,去年还获批用于治疗PIK3CA相关过度生长疾病谱系(PROS)成人和2岁及以上儿童患者新的适应症,今年上半年得销量大幅度增加至2.46亿美元。
国内目前获批上市的只有石药集团从Verastem引进的PI3Kδ/γ双重抑制剂度维利塞胶囊(Duvelisib)和璎黎/恒瑞的林普利塞片。近期,林普利塞拟纳入优先审评,用于既往接受过一线充分治疗的复发和/或难治性外周 T/NK 细胞淋巴瘤成人患者。
尽管PI3K的药物研发遭受挫折,但是还是有很多药企仍然在开发不同类型的PI3K抑制剂以及探索它们新的适应症,如pan-PI3K,亚型选择性PI3K抑制剂或者靶向PI3K突变位点的选择性,希望能够减少毒副作用,提高安全性。
References
1.Yan He, Miao Miao Sun, Guo Geng Zhang, Jing Yang, Kui Sheng Chen, Wen Wen Xu and Bin Li, Targeting PI3K/Akt signal transduction for cancer therapy, Signal Transduction and Targeted Therapy (2021) 6:425)
2.https://www.fda.gov/media/161777/download.
3.Discovery and characterization of RLY-2608, the first allosteric, mutant, and isoform-selective inhibitor of PI3Kα.
4.https://www.loxooncology.com/docs/publications/sabcs2022_puca.pdf
5.Scorpion Therapeutics Announces First Patient Dosed in Phase 1/2 Clinical Trial of STX-478, Its Mutant-Selective PI3Kα Inhibitor for the Treatment of Breast Cancer and Other Solid Tumors – Scorpion Therapeutics (scorpiontx.com).
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx