战胜Keytruda(K药),是众多肿瘤免疫治疗产品的目标。
日前,阿斯利康在Clinicaltrials.gov网站上注册了PD-1/CTLA-4双抗(MEDI5752)+化疗联合治疗非小细胞肺癌(NSCLC)的三期临床,值得注意的是,该三期临床以K药+化疗标准疗法为对照组。
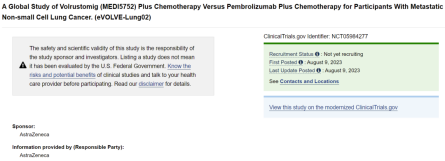
非小细胞肺癌,向来是肿瘤药企业“兵家必争”的领域,而K药,无疑是该细分领域的“超级巨星”。作为PD-1抑制剂的领头羊,K药去年在全球大卖209.37亿美元,距离登上“新药王”的宝座仅一步之遥。
据悉,MEDI5752是阿斯利康开发的一种单价双特异性抗体,可同时靶向PD-1和CTLA-4,可优先结合PD-1+活化T细胞中的CTLA-4,从而在保证安全性的前提下产生更多的T细胞,比单药PD-1更为显著。
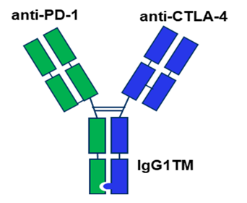
MEDI5752的结构
行业观点认为,肺癌是全球高发的恶性肿瘤,当年K药反超O药(百时美施贵宝的Opdivo)的癌种选择也是非小细胞肺癌。阿斯利康在研的PD-1/CTLA-4双抗在早期研究中展示出不俗的潜力,本次能否实现“弯道超车”极具看点。同时,稳坐目前最为火爆的PD-1领域“头把交椅”的K药,也在面临越来越多后来者发起的“头对头”挑战。
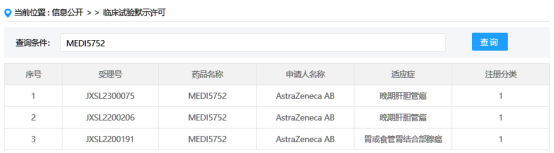
据国家药监局药审中心网站查询显示,目前MEDI5752在中国布局的适应症为晚期肝胆管癌、胃或食管胃结合部腺癌。
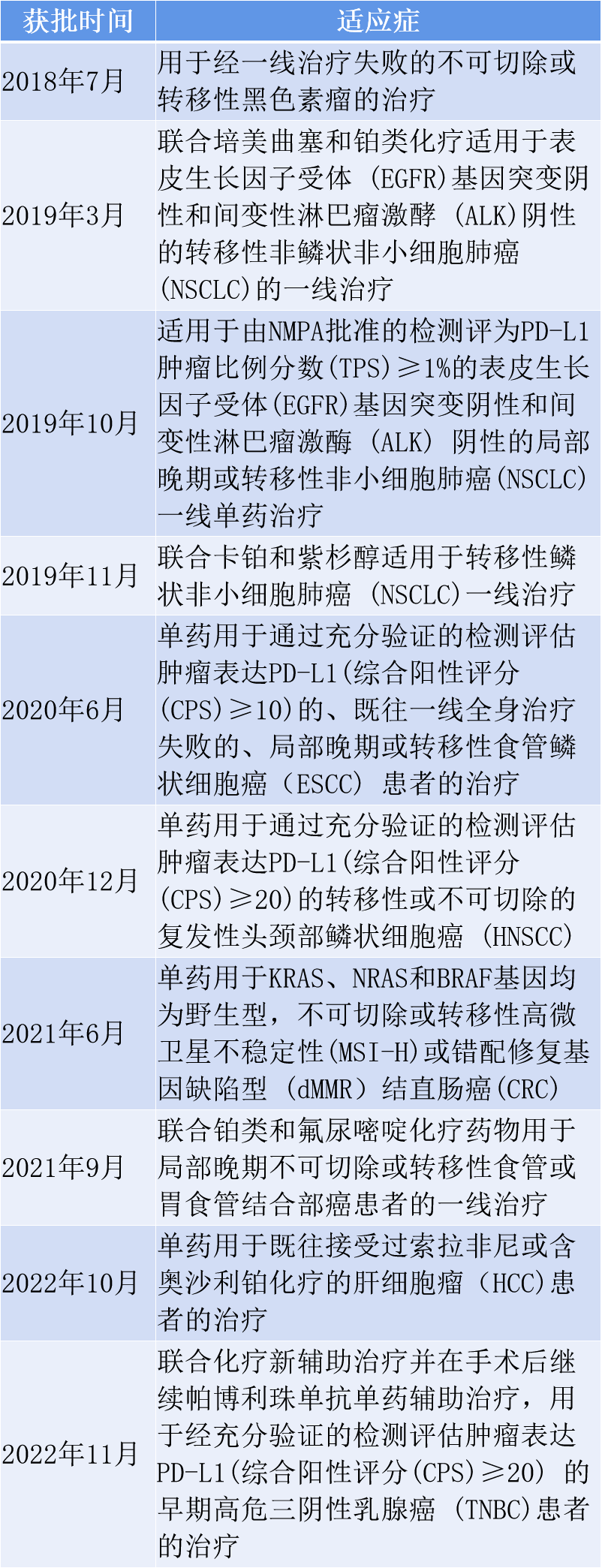
在转移性非小细胞癌领域,K药是当仁不让的王者,斩获了四个相关适应症(其中三个为一线治疗)。
K药是由默沙东自主研发的一款PD-1人源化单克隆抗体。2014年9月4日,在美国首次获批上市;2018年7月20日,K药在中国获批上市。
截至目前,K药已经在中国获批了10项适应症,覆盖癌种包括黑色素瘤、(鳞状或非鳞状)非小细胞肺癌、食管鳞状细胞癌、头颈部鳞状细胞癌、结直肠癌、食管癌、肝细胞癌和三阴性乳腺癌。
不过,随着医药生物技术的发展,双抗药物横空出世,历经十余年的开发研究,如今逐渐成为肿瘤治疗领域的新宠儿。根据公开信息,此次阿斯利康注册的MEDI5752+化疗联合治疗NSCLC的三期临床选择了差异化的适应症,即限定PD-L1低表达的NSCLC患者,计划入组900例NSCLC患者,预计2028年5月初步完成。
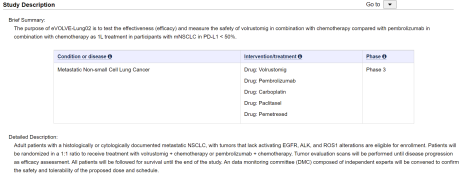
一年前,2022年9月,在欧洲肿瘤内科学会(ESMO)大会上,MEDI5752用于一线治疗非鳞状NSCLC的最新临床试验结果发布,即引发行业广泛关注。
在这项1b/2期临床试验中,患者在接受化疗后,随机接受MEDI5752/化疗组合,或者K药/化疗组合的治疗。
试验结果显示,在接受剂量为1500mg(每3周一次) MEDI5752治疗的患者组中,患者的中位缓解持续时间(DOR)为20.5个月,活性对照组为9.9个月。MEDI5752组的中位无进展生存期 (PFS)为15.1个月,活性对照组为8.9个月。MEDI5752组在总生存期方面也表现出优势。在PD-L1表达水平小于1%的患者中,MEDI5752组的DOR、PFS和总生存期 (OS)也都更长。此外,750mg剂量的MEDI5752表现出类似的可喜疗效,并且改善了耐受。
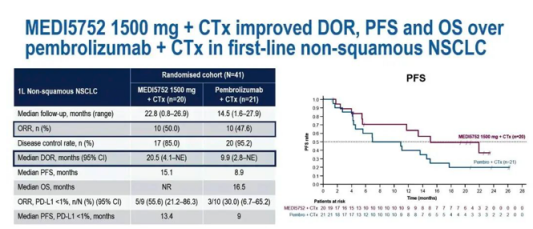
从研究结果来看,与K药/化疗组相比,MEDI5752用于非鳞状NSCLC一线治疗时,15000mg剂量的方案可改善患者DOR、PFS和OS,而750mg剂量的方案同样有令人鼓舞的疗效,耐受性也得到改善。
据悉,MEDI5752是一种由CTLA-4单抗Tremelimumab与一种PD-1单抗组合而成的单价双抗,相比二价双抗不会引起受体同二聚化,靶向性更强。
PD-1/CTLA-4免疫双抗,分别作用于免疫的不同环节,具有不同效应。CTLA-4主要作用于启动阶段,是抗原呈递阶段的主要影响因素。而PD-L1主要作用在效应阶段,阻断免疫检查点从而杀伤肿瘤。因此,同时阻断CTLA-4和PD-L1可能会增强抗肿瘤作用。
此外,临床前研究表明,MED15752不仅能够介导CTLA-4的内吞,而且能够介导PD-1的内吞和降解(依赖于CTLA-4的表达),这是其它PD-1相关抗体没有的功能。
业内人士指出,阿斯利康MEDI5752在2期临床中即与K药头对头,此次选择了PD-L1低表达NSCLC来切入3期临床。从目前披露数据来看,PD-1/CTLA-4双抗MEDI5752展示出有前景的疗效和可控的安全性,数据亮眼,或能在与K药的头对头挑战中成功。
“头对头”研究是指非安慰剂对照研究,也就是两种或多种方案在同一研究内同时进行的平行对照试验,方案间具有完全可比性,属于高级别的研究证据。
在临床开发中,通过“头对头”挑战临床标准疗法或代表性明星药物,往往能赢得更大的关注。目前, K 药是美国国立综合癌症网络(NCCN )推荐的 PD-L1 阳性 NSCLC 首选治疗方案。因此,其他疗法在挑战这一大适应症之前,往往都需要证实相较于这一标准疗法的临床获益,才更能获得监管机构和医生的认可。
除了MEDI5752,全球至少已有超过十家药企以K药为阳性对照药开展“头对头”3期临床试验,国内企业中恒瑞医药、百济神州、乐普生物、正大天晴、康方生物等已开展相关产品与K药头对头的3期临床研究。
在已上市、申请上市和III期在研的国产PD-(L)1药物(包括双抗)中,已经有康方生物的依沃西单抗(AK112)、正大天晴的TQB2450、恒瑞医药的卡瑞利珠单抗,以及百济神州的替雷利珠单抗正在III期临床试验中正面对决K药。

其中,康方生物自主研发的依沃西单抗的上市申请已在本月获受理。
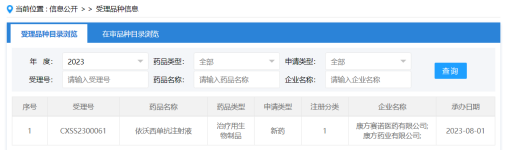
依沃西单抗是一款PD-1/VEGF-A双抗,机制相比PD-1单抗更有优势。此前,依沃西单抗曾先后3次被CDE纳入突破性治疗品种,针对适应症包括:一线治疗PD-L1表达阳性的局部晚期或转移性NSCLC;联合化疗治疗经EGFR-TKI治疗失败的EGFR突变的局部晚期或转移性非鳞NSCLC;联合多西他赛治疗既往PD-(L)1抑制剂和含铂化疗治疗耐药的局部晚期或转移性NSCLC。
TQB2450 是正大天晴自主研发的一款全新序列的创新全人源化抗 PD-L1 单克隆抗体,目前处于申请上市阶段,首发适应症为小细胞肺癌。
卡瑞利珠单抗是国内第3款上市的国产PD-1单抗,其获批的适应症已有6项,包括霍奇金淋巴瘤、食管鳞状细胞癌、鼻咽癌、肝细胞癌、鳞状和非鳞状NSCLC。
去年10月,CDE授予卡瑞利珠单抗联合法米替尼一线治疗PD-L1 TPS≥1%且不伴有EGFR/ALK基因异常的复发或转移性NSCLC 突破性疗法的认定。
百济神州的替雷利珠单抗是目前获批适应症最多的国产PD-1单抗。继百济神州的BTK抑制剂泽布替尼在头对头研究中战胜了伊布替尼之后,替雷利珠单抗的头对头研究也引起万千期待。
NSCLC是肿瘤免疫竞争异常激烈的瘤种,当前,敢于对K药发起头对头挑战的临床试验登记正在增多,除了PD-(L)1抑制剂外,未来一线NSCLC用药还有PD-(L)1的双抗、TIGIT单抗或双抗、Trop2抗体偶联药物、KRASG12C抑制剂等产品。
行业观点认为,免疫联合疗法的新时代即将到来。在研药物如果能通过“头对头”研究战胜K药,便能以“踩在巨人肩膀上”的方式赢得可观的商业化前景。如今,群狼环伺之下,K药将在何时被何药拉下神坛?
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx