国家药监局药品审评中心日前显示,南京正大天晴的哌柏西利片申报上市,该产品为国内第3款申报上市的哌柏西利片剂仿制药。此前,齐鲁制药和石药集团开发的哌柏西利片已在去年提交上市申请。
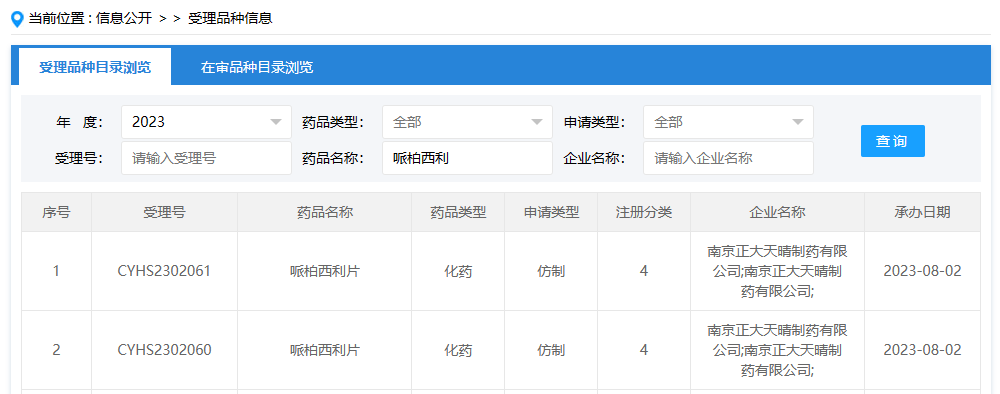
哌柏西利是全球首个上市的细胞周期蛋白依赖性激酶(CDK)4/6抑制剂,可通过抑制CDK4/6恢复细胞周期控制,从而阻断肿瘤细胞增殖。哌柏西利为辉瑞原研药,2015年2月在美国上市。2018年7月,辉瑞哌柏西利胶囊获国家药监局批准上市,用于治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌,商品名为爱博新®。
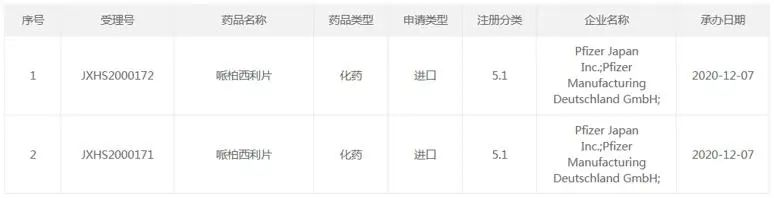
目前,国内哌柏西利制剂已有哌柏西利胶囊和哌柏西利片获批,其中,哌柏西利胶囊有辉瑞、齐鲁制药、湖南科伦制药等8家企业拥有生产批文,江苏正大天晴药业、江西艾施特制药、先声药业等7家企业报产在审;哌柏西利片则仅有辉瑞1家拥有生产批文,齐鲁制药和石药集团欧意药业报产在审。
市场观点认为,哌柏西利作为备受市场关注的肿瘤药物重磅品种,原研药经历“专利悬崖”,这对于本土仿制药企业而言将带来争夺市场份额的重要机会;不过,随着仿制药产品获批数量增加,带量采购的降价压力也不容小觑,值得进一步关注。
01
明星抗癌药直面“专利悬崖”
乳腺癌是目前治疗效果较好的癌症之一,5年的生存率可以高达90%。一般会使用手术治疗、化疗、放疗、靶向治疗、内分泌治疗等手段。医生会根据患者的病情选择不通用的组合拳来进行治疗。乳腺癌患者中有60%属于激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)的乳腺癌。其中CDK4/6抑制剂是近年来HR+/HER2-晚期乳腺癌一、二线治疗领域最成功的一类新药。
作为全球首个上市的CDK4/6抑制剂,2015年2月,辉瑞Ibrance通过加快审评在美国获FDA批准上市,成为全球上市的首个CDK4/6抑制剂,哌柏西利胶囊于2018年7月获NMPA批准上市。用于与芳香化酶抑制剂联用作为局部晚期或转移性HR+,HER2-绝经后女性乳腺癌患者初始内分泌治疗。
PALOMA-2研究结果显示,哌柏西利联合内分泌治疗一线治疗中位无进展生存时间为27.6个月,显著优于内分泌单药治疗14.5个月。美国P-REALITY、IRIS等真实世界研究,显示哌柏西利在HR+/HER2-晚期乳腺癌治疗中的总生存期获益。如今,哌柏西利等CDK4/6抑制剂已成为中外重要指南的HR+/HER2-晚期乳腺癌的一线首选方案。
哌柏西利片是辉瑞开发的继胶囊剂之后的另一口服剂型,于2019年11月获FDA批准,有75mg、100mg、125mg三个规格。该品种于2020年12月向CDE递交上市申请,并于2022年8月在中国获批上市。
据不完全统计,2019年乳腺癌市场总额为202亿美元,主要来自HER2靶向药物和CDK4/6抑制剂的销售贡献。据米内网数据显示,2021年原研产品在全球范围的销售额已超过50亿美元。2021年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端及中国城市实体药店终端哌柏西利胶囊销售额突破2亿元,同比增长69.4%。
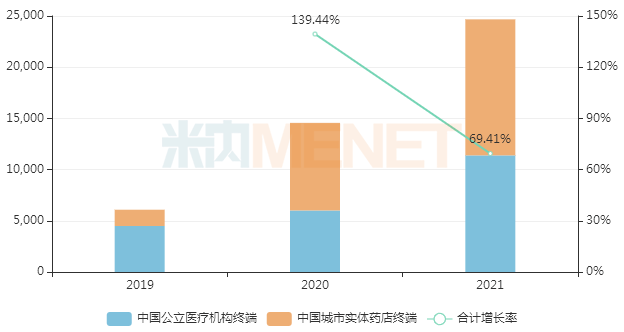 中国公立医疗机构终端及中国城市实体药店终端
中国公立医疗机构终端及中国城市实体药店终端哌柏西利胶囊销售情况(单位:万元)
2023年1月31日,辉瑞公司公布了2022全年营收数据,其中CDK4/6抑制剂Ibrance( 哌柏西利)2022年全球销售额为51.2亿美元,同比下降6%。
02
CDK4/6市场争夺战正式打响
CDK4/6抑制剂已成为乳腺癌治疗的一类重要靶向药物,凭借其先发优势,辉瑞Ibrance上市后其全球销售额每年均呈稳定增长,为辉瑞带来相当丰厚的收益。
不过,哌柏西利正在遭遇到“专利悬崖”引发的仿制药市场冲击。
据悉,国内已有多家药企的哌柏西利胶囊仿制药获批,其中,齐鲁制药、药友制药、豪森药业、奥赛康等6家公司的产品已经获得药品批准文号。除此之外,布局哌柏西利片剂仿制药的药企已有正大天晴、齐鲁制药和石药集团等多家企业。
行业观点分析认为,作为乳腺癌领域的一款重磅品种,国内哌柏西利市场,未来随着仿制药加速获批和上市,辉瑞或将逐步失去“一家独大”的局面。庞大乳腺癌市场,胶囊剂和片剂,仿制药与原研混战局面一触即发。
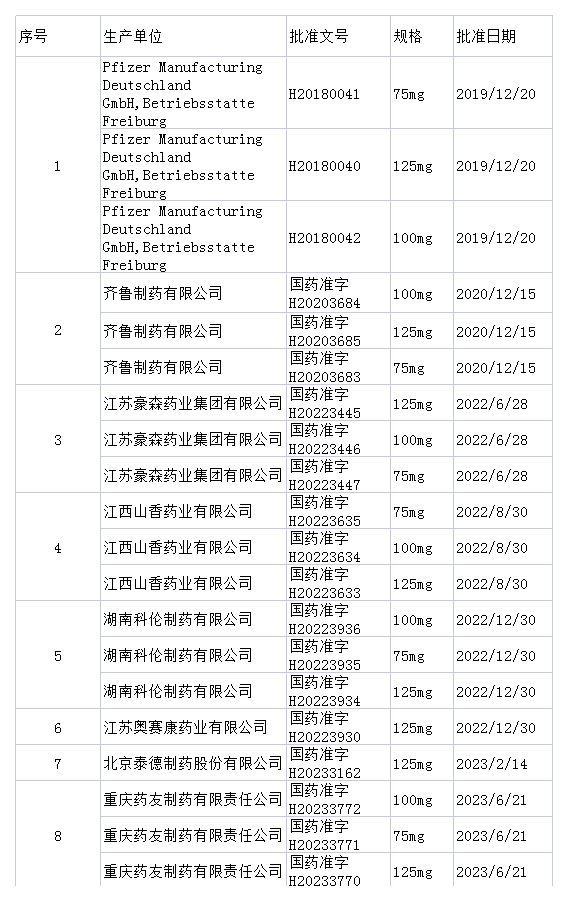
哌柏西利胶囊已获批企业情况(不完全统计)
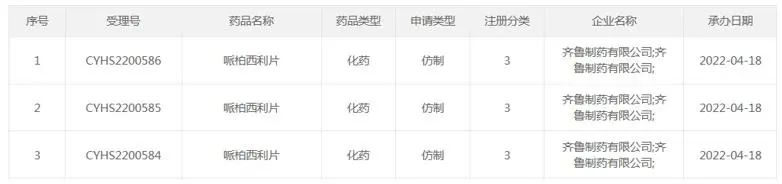
齐鲁制药自拿下哌柏西利胶囊的首仿后,产品(商品名:齐妥欣®)已经在今年2月正式上市。此外,齐鲁制药也递交了哌柏西利片的上市申请,并于2022年4月获CDE受理。据CDE官网显示,齐鲁制药递交的3类仿制药哌柏西利片的上市申请,是首家递交该品种上市申请的药企。
2022年12月24日,CDE官网显示,石药欧意的4类仿制化药哌柏西利片上市申请获受理。
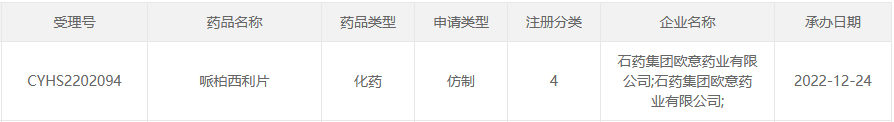
据了解,2022年5月9日,石药欧意公示了其哌柏西利片的生物等效性试验,规格为125mg,适用于激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性的晚期或转移性乳腺癌,应与芳香化酶抑制剂联合使用作为绝经后女性或男性患者的初始内分泌治疗或与氟维司群联合使用用于内分泌治疗后疾病进展的患者。同年8月17日,该项BE试验完成。
除此之外,随着哌柏西利原研药专利到期,国内市场的争夺战即将拉开。后续仿制药的上市势必对其市场造成冲击。同时,同类CDK4/6抑制剂的竞争也是愈演愈烈,截至目前,国内共有5款CDK4/6抑制剂获批上市,即辉瑞的哌柏西利、礼来的阿贝西利、恒瑞医药自主研发的达尔西利、先声药业引进的曲拉西利和诺华的瑞波西利。
据公开资料整理,国内已有40多家企业布局了CDK4/6抑制剂赛道,正大天晴、贝达药业等多家知名企业均已入场,市场红海在即。仿制药的上市势必对其市场造成冲击,不过这也意味患者将拥有更丰富的临床治疗选择。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx