7月28日,罗氏在国内递交的「奥瑞利珠单抗注射液」进口申请获CDE受理。奥瑞利珠单抗(ocrelizumab,Ocrevus)是一种靶向B细胞表面分子CD20的人源化单克隆抗体,其静脉注射剂最早于2017年3月被FDA批准用于治疗复发型多发性硬化症(RMS),包括复发-缓解型MS(RRMS)、活动性或复发性继发进展型MS(SPMS)、临床孤立综合征(CIS)和原发进展型多发性硬化症(PPMS)。
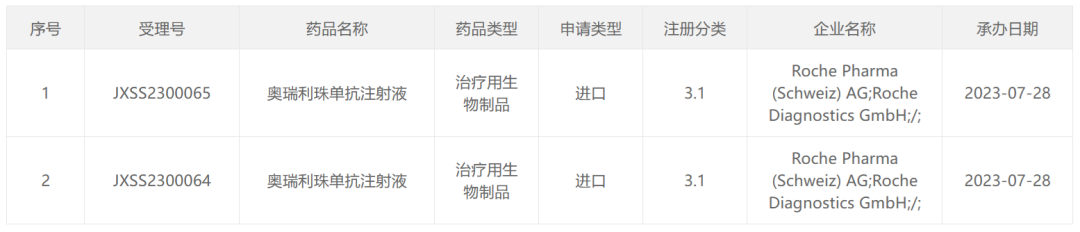
图1. 奥瑞利珠单抗注射液获CDE受理,来源:CDE官网
此外,罗氏还开发了奥瑞利珠单抗皮下制剂,该皮下制剂将Ocrevus与Halozyme Therapeutics的Enhanze药物传递技术结合。Enhanze药物传递技术是基于其专有重组人透明质酸酶PH20(rHuPH20),其可在皮下局部和暂时降解透明质酸,增加皮下组织的渗透性,为大分子提供空间进入,并使得皮下制剂可以迅速分散并吸收进入血流中。
今年7月,罗氏宣布Ocrevus皮下制剂治疗RMS或PPMS的3期临床试验OCARINA II达到主要和次要终点。结果显示:通过12周的药代动力学检视证实,Ocrevus皮下注射与静脉输液(IV)给予的Ocrevus相较达非劣效性。而且,Ocrevus皮下注射制剂在控制颅脑磁共振成像(MRI)病变活动方面,也与静脉输注的Ocrevus相当。
Ocrevus一上市就成为多发性硬化症(MS)的爆款药物,销售额一路攀升,并于2020年赶超渤健的Tecfidera(富马酸二甲酯,2017年至2019年MS领域的销售额冠军),2022年增长至65.39亿美元。
Ocrevus优秀的市场表现与其6个月的给药周期有着不可分割的关系,不过其静脉给药时输注时间长,需3.5小时或2小时。Ocrevus皮下制剂给药更加便捷,每次仅需10分钟,每年给药两次,预计新的给药方式将使Ocrevus的销售额再创新高。
此次,Ocrevus在国内申报上市,期待其可以早日获批,造福众多国内MS患者。
多发性硬化症及其治疗现状
多发性硬化症(MS)是一种免疫介导的慢性、致残性中枢神经系统炎性脱髓鞘性疾病,常累及脑室周围、近皮质、视神经、脊髓、脑干和小脑。MS临床表现多样,与累及的神经支配的功能相关。常见症状包括视力下降、复视、肢体感觉障碍、肢体运动障碍、共济失调、膀胱或直肠功能障碍。患者由于身体逐渐硬化,被称为“木偶人”。
MS是导致青年人非创伤性残疾的首要原因之一,据统计,全球约有350万MS患者,大多数患者在20-40岁之间症状初次发作,而且该病好发于20至40岁中青年女性。
目前,MS发病原因不明,被认为是环境因素和遗传因素共同作用,导致机体丧失对自身蛋白(髓鞘抗原)耐受性所致的自身免疫性疾病。
根据病程,MS可分为四型,即复发缓解型(RRMS,约占85%)、继发进展型(SPMS)、原发进展型(PPMS,约占10%)和进展复发型(PRMS,约占5%),其中80% RRMS可发展为SPMS。
疾病修正治疗(DMT)是MS患者缓解期的标准治疗方案。该疗法通过抑制或调节免疫功能来改变MS进程,主要在MS的复发阶段发挥抗炎活性、降低复发率,减少MRI损伤的累积,稳定、延缓并适度改善残疾状况。
据不完全统计,2010年以来全球监管机构批准了多款MS药物,详见下表。可以看出,近年批准的MS药物大多围绕选择性鞘氨醇-1-磷酸受体(S1PR)和CD20。
表1. 2010年后全球监管机构批准的MS新药,来源:药渡数据库(不完全统计)
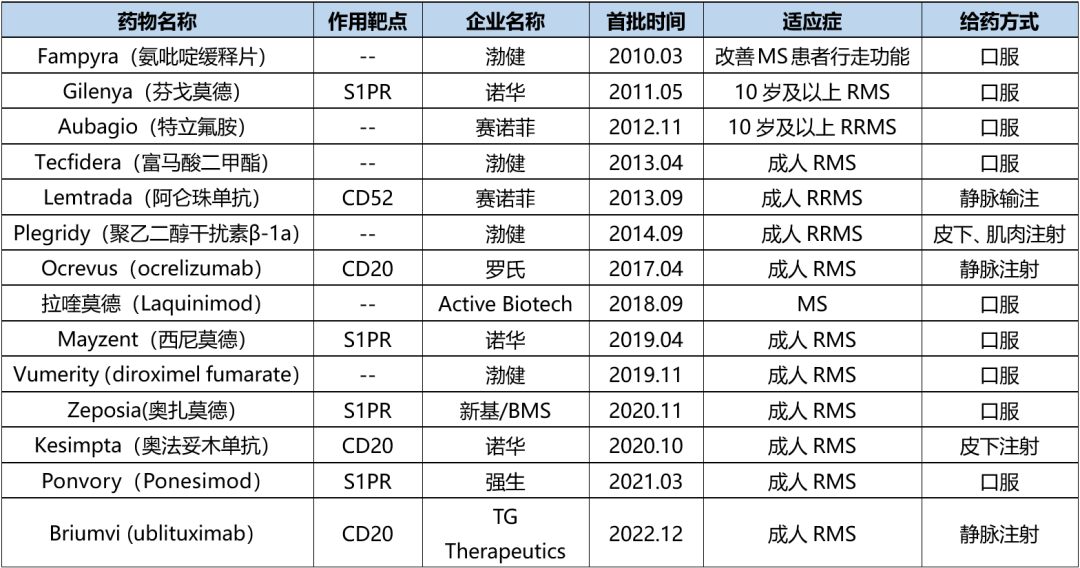
值得一提的是,MS药物市场已出现多款销售额超10亿美元的重磅产品,如Ocrevus、Aubagio、Gilenya和Tecfidera ,其2022年销售额分别为65.39亿美元、21.66亿美元、20.13亿美元和14.44亿美元。
CD20与多发性硬化症
CD20是位于B细胞上的一种非糖基化磷蛋白,属于MS4A蛋白家族(四次跨膜蛋白家族A),主要在前B细胞到成熟B细胞阶段表达。CD20蛋白由四个疏水跨膜结构域组成,一个胞内结构域和两个胞外结构域(大环和小环),N端和C端均位于胞质内。
由于CD20在正常和恶性B淋巴细胞表面表达,但在造血干细胞、血浆细胞和其他正常组织中不表达,CD20被认为是一个治疗B细胞恶性肿瘤及自体免疫疾病的重要靶点。
目前,全球已批准多款CD20靶向药,这些药物大多被批准用于治疗滤泡性淋巴瘤、慢性淋巴细胞白血病、弥漫性大B-细胞淋巴瘤等肿瘤。仅奥瑞利珠单抗(ocrelizumab,Ocrevus)、奥法妥木单抗(Ofatumumab,Kesimpta)和Briumvi(ublituximab)三款药物被批准用于治疗MS。
奥法妥木单抗
奥法妥木单抗是Genmab(2006年授权给GSK开发)开发的一款CD20靶向全人源单抗,最早被开发用于治疗慢性淋巴细胞性白血病(CLL)。2015年,诺华从GSK获得奥法妥木单抗的经营权,并将其作为新一代B细胞耗竭剂开发。2020年8月,奥法妥木单抗被FDA批准用于治疗成人RMS,包括RRMS、SPMS和CIS,商品名为Kesimpta。Kesimpta通过皮下注射给药,每月注射一次。
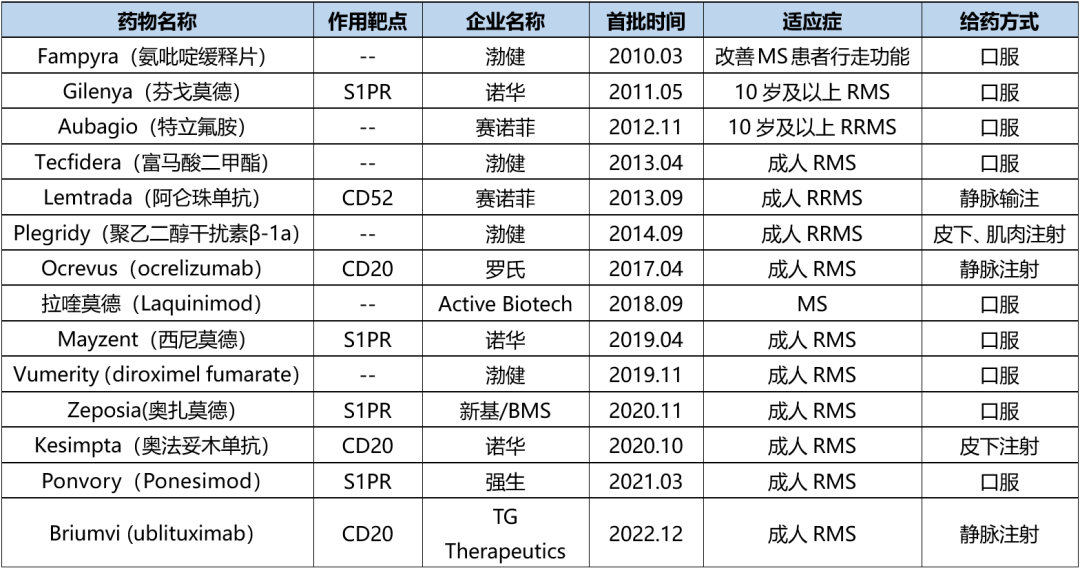
图2. 奥法妥木单抗作用示意图,来源:药渡数据库
目前,Kesimpta已于2021年12月在国内被批准用于治疗成人RMS,商品名全欣达®。而且,该药还进入了2022年国家医保目录。
Briumvi
Briumvi(ublituximab)是一款靶向CD20的糖工程化单克隆抗体。2022年12月,TG Therapeutics宣布Briumvi被FDA批准用于治疗RMS,包括RRMS、SPMS和CIS。
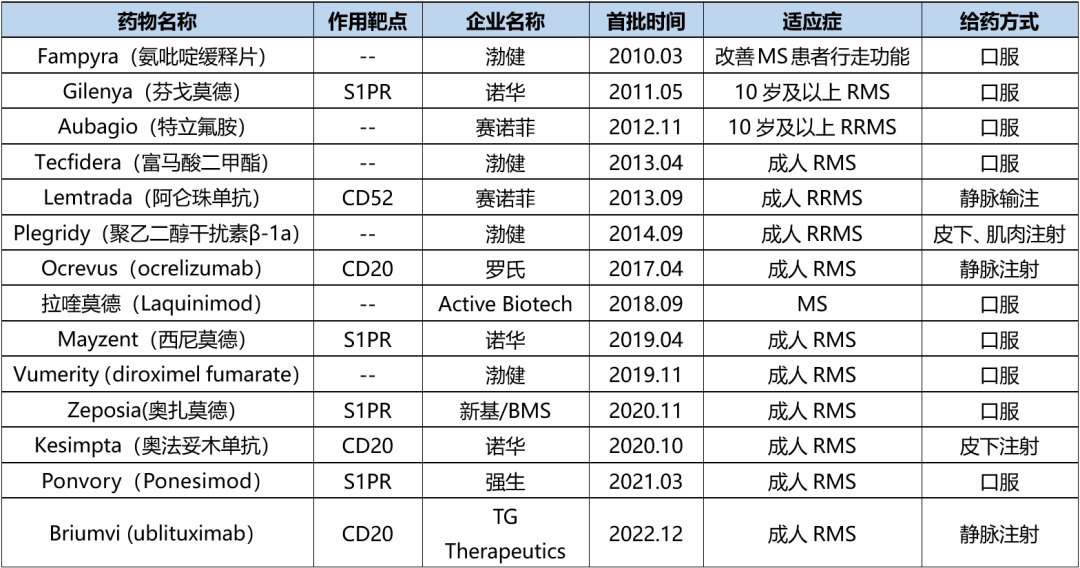
图3. Briumvi作用示意图,来源:药渡数据库
Briumvi通过静脉注射给药,其给药方案包括第一天在4小时内输注150mg,第15天在1小时内输注450mg,然后每24周在1小时内输注450mg。
此外,目前还有几款CD20药物被开发用于治疗MS,如Biocad的BCD-132、罗氏的RO 7121932。
小 结
据frost&sullivan预测,2030年全球MS药物市场规模将由2019年的235亿美元增长至315亿美元,而我国国内市场将从3亿美元快速增长至21亿美元。整体来看,目前MS药物市场仍未饱和,但竞争已十分激烈,畅销药冠军已由Tecfidera移交给Ocrevus。
除了研发MS新药,研发机构更是在持续优化已上市MS药物给药方式。
参考资料:
1. 药渡数据库
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx