
已上市后药品生产过程中的变更是不可避免,2023年7月11日,笔者从上海市药品监督管理局平台查询得知,上海市药品监督管理局发布关于公开征求《上海市药品上市后变更备案管理实施细则》(征求意见稿)意见的通知(成文日期:2023年7月11日),公开征求意见时间:2023年7月12日至8月11日。上海市药品监督管理局2021年01月发布了《关于药品上市后变更管理类别沟通交流事项的的通告》,明确了药品上市后变更管理类别沟通交流相关要求,但未发布药品上市后变更备案管理实施细则,那么本次发布药品上市后变更备案管理实施细则有哪些亮点值得关注呢?本文流程不能涵盖所有变更情形,仅供参考。
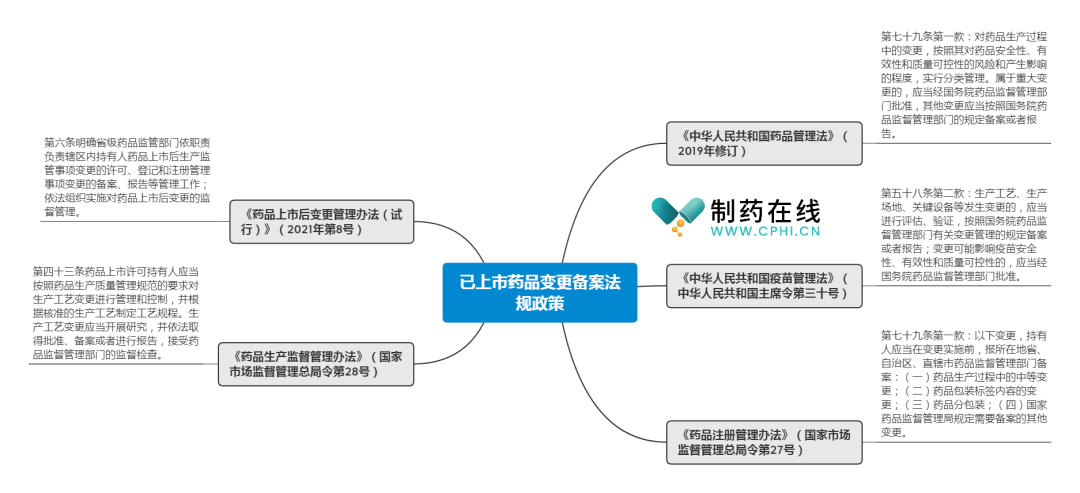
一、已上市药品变更备案法规政策依据
二、新规适用于哪些药品上市后变更?
2019年12月1日实施的新修订《药品管理法》中单独提出了药品上市后变更管理章节,2021年1月13日发布实施的《药品上市后变更管理办法(试行)》,进一步明确了备案类变更的基本程序,并要求省级药监部门对备案变更管理工作制定具体程序,《上海市药品上市后变更备案管理实施细则》对备案类变更的适用范围进行了明确,并强调药品上市许可持有人和原料药登记企业药品上市后变更备案类变更按本实施细则的要求向市局备案后实施。

三、新规对上市后药品变更备案办理流程影响几何?
笔者检索了上海市药品监督管理局当前上市后药品变更备案办理流程图,如下:
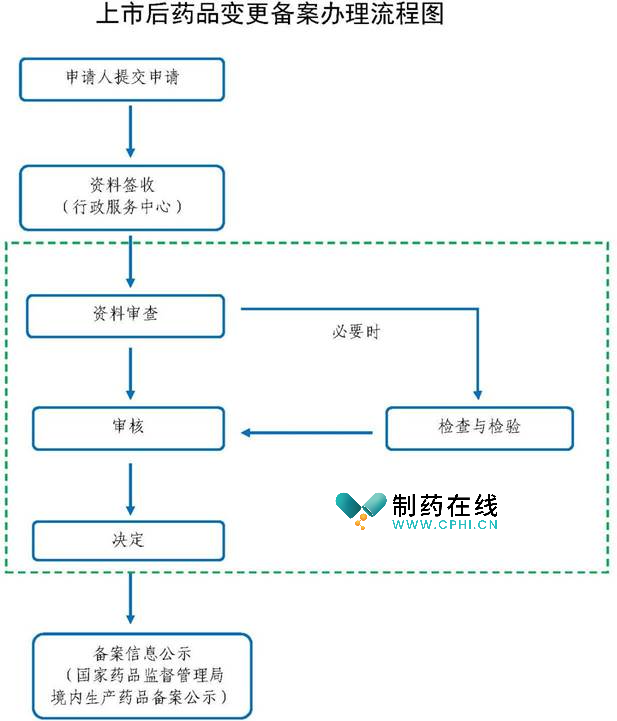
注意事项:特别程序,检查与检验(必要时)。
那么上海局发布《上海市药品上市后变更备案管理实施细则》的备案类变更的工作程序是什么?是否对现有备查流程有影响?是作为变更控制管理人员比较关心的问题,笔者按照办理流程关键节点进行梳理分析。
上海市已上市药品变更备案流程变化对照表

参考文献
[1] 上海市药品监督管理局官网等
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx