作为“降糖+减肥”双领域引发巨大关注的“顶流”靶点,GLP-1一直保持着市场热度。
在日前召开的美国糖尿病协会第83届年会科学会议上,围绕GLP-1领域的行业布局,不仅有跨国大药企礼来、勃林格殷格翰等企业均公布了相关产品最新研发进展,还有包括恒瑞医药、先为达、硕迪生物、银诺医药等在内的国内创新药企崭露头角。
然而,就在GLP-1喜讯频出之际,一则GLP-1药物被欧洲药品管理局(EMA)标记为甲状腺癌的潜在风险的新闻,也引发业内对于合理用药的审慎思考。市场观点认为,在庞大的需求下,本次EMA发出的提醒,或许能给GLP-1过度火爆的创新热潮“降降温”。
1
GLP-1研发进展喜人
全球大厂纷至沓来
礼来作为耀眼新星中的明星,本次携数个产品亮相会议。首先,在小分子GLP-1R赛道上,Orforglipron已经进入三期临床阶段,此次ADA会议上公布了糖尿病和减重两项二期临床的数据,同时这两项二期临床数据同步发表在柳叶刀和新英格兰期刊上。

Orforglipron减重二期临床中,45mg剂量组治疗36周减重14.7%,相比安慰剂减重12.4%。糖尿病二期临床中,Orforglipron治疗26周Hb1Ac降低2.1%,减重10.1kg,安慰剂和度拉糖肽组分别降低0.43%和1.10%,减重分别为2.2kg和3.9kg。由此可见,口服小分子Orforglipron无论是降糖还是减重效果,都明显超过度拉糖肽。
礼来同时公布了GLP-1R/GIPR/GCGR三靶点激动剂Retatrutide治疗肥胖、NAFLS、糖尿病的二期临床数据。同时还表示,已经启动Retatrutide的三期临床,认为其有望在Tirzepatide基础上进一步提高疗效,预期最高剂量可以减重22-24%,主要是脂肪的减少,预计降糖效果可以将Hb1Ac降低2%。
值得注意的是,信达生物和礼来合作开发产品GLP-1R/GCGR双靶点激动剂Mazdutide的临床前数据也在会上公布,不过该产品此前已经披露了Ⅱ期临床数据,糖尿病二期临床Mazdutide治疗20周Hb1Ac降低1.67%,安慰剂度为0.03%,度拉糖肽对照组为1.35%。肥胖二期临床,6mg剂量组Mazdutide治疗24周体重相对安慰剂组减轻12.62%。
勃林格殷格翰/Zealand则在ADA会议上公布了GLP-1R/GCGR双靶点激动剂Survodutide治疗超重/肥胖患者的二期临床数据,患者经过20周计量爬坡和26周维持治疗,4.8mg剂量组治疗46周后减重19%,超过40%的患者减重超过20%。
Carmot Therapeutics公司也展示了GLP-1R/GIPR双靶点激动剂CT-388,其作为Carmot Therapeutics的核心管线,上个月刚刚完成1.5亿美元E轮融资,用于推进该产品的临床开发。国际上还有韩国D&D公司GLP-1R/GCGR双靶点激动剂DD01,印度太阳药业GLP-1R受体激动剂GL0034,Terns Pharmaceuticals公司小分子GLP-1R激动剂TERN-601等多款药物公布了相关研究数据。
与此同时,亦有数家国内创新药企秀肌肉。
Ecnoglutide(XW003)是先为达研发的具有偏向性的新型长效GLP-1受体激动剂,经优化提高生物活性,降低生产成本,并满足每周给药一次。在I期和II期临床研究中,Ecnoglutide表现出良好的安全性和耐受性,且2型糖尿病患者和肥胖症患者均有获益。本次ADA 2023年会上公布了三项最新数据。
Ecnoglutide糖尿病2期临床,0.4mg、0.8mg、1.2mg治疗20周,Hb1Ac降低1.81%-2.39%,安慰剂组降低0.55%。肥胖2期频次,1.2mg、1.8mg、2.4mg治疗26周,体重降低11.5%、11.2%、14.7%,利拉鲁肽3.0mg组降低8.8%。基于以上临床研究的积极结果,先为达于今年年初启动Ecnoglutide中国III期注册临床试验的受试者招募,目前均已完成全部受试者入组,预计将于2024年获得顶线数据。
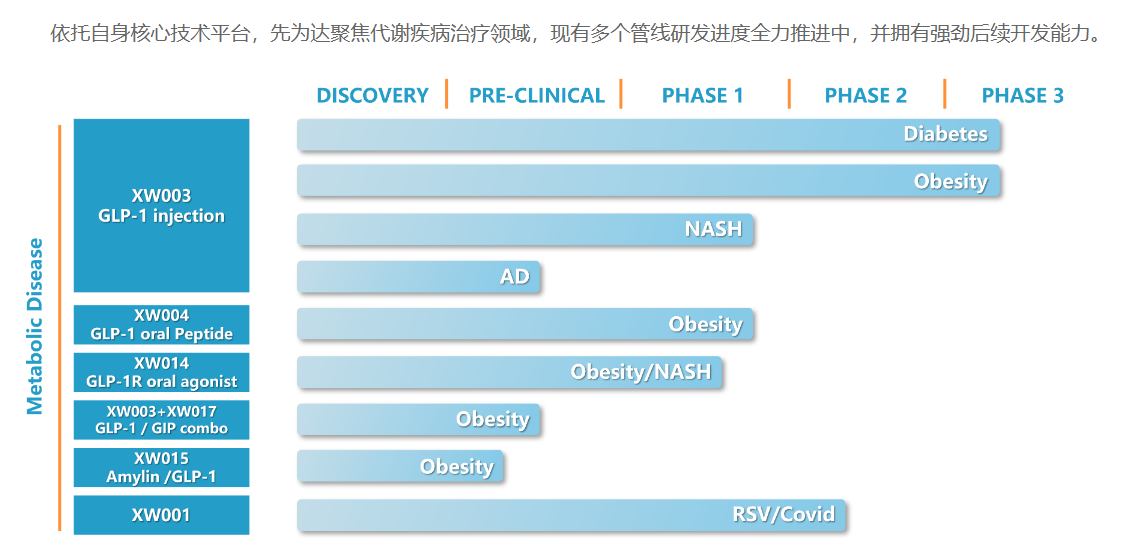
恒瑞医药则公布了口服小分子GLP-1RA(HRS-7535)和GLP-1/GIP双受体激动剂(HRS9531)临床I期数据。HRS-7535的I期临床数据中,SAD和MAD各24例,MAD治疗29天体重下降4.38kg。HRS9531 SAD部分60例,MAD部分30例;MAD中,0.9-5.4mg组第29天时平均减重4.3-7.7kg,5.4mg剂量组治疗36天减重8.0kg。这些数据无疑会支持HRS-7535、HRS9531的进一步临床开发。
除了恒瑞、先为达、信达等企业,国内还有银诺医药公布了苏帕鲁肽单药治疗、联合二甲双胍治疗二型糖尿病的临床数据;硕迪生物小分子GLP-1R激动剂GSBR-1290的最新临床数据也发布,并表示今年底将获得该药糖尿病和肥胖2a期临床治疗12周的初步疗效数据。
2
GLP-1合理用药警示
Off-label需谨慎
6月22日,据媒体报道,欧盟EMA已将GLP-1药物标记为甲状腺癌的潜在风险,包括诺和诺德的Ozempic和Wegovy,以及礼来的Mounjaro。监管机构要求相关在7月26日之前提交更多信息。

EMA对于GLP-1类药物的安全性担忧,源于去年发表的一项临床研究。2022年11月10日,《糖尿病护理》杂志上刊登了一篇名为《GLP-1受体激动剂与甲状腺癌的风险》的研究。
研究人员对2006年至2018年期间接受二线治疗的2型糖尿病患者进行了研究。在排除有癌症病史的人后,研究人员分析了2572名甲状腺癌患者和45184名未患甲状腺癌患者的数据。结果显示,与不使用者GLP-1类药物的患者相比,使用 GLP-1类药物1-3年或超过3年的患者高甲状腺癌发生率更高。
据悉,EMA已经加强了对GLP-1治疗的审查,此举是监管机构监测可能与使用已批准药物有关的潜在不良事件的第一步。诺和诺德在一份声明中表示:“诺和诺德意识到EMA的信号和要求,并将对所有相关数据进行彻底评估,以阐明这一主题。”受此消息影响,诺和诺德近日股市持续下跌。
实际上,GLP-1中“网红明星”产品司美格鲁肽的临床前试验中,就出现了小鼠甲状腺C细胞肿瘤发病率增加的情况。发表在《柳叶刀》上的一项研究也表明,长期服用利拉鲁肽长达104周的大鼠小鼠,会以剂量依赖性方式导致甲状腺C细胞增生和C细胞肿瘤形成。对此,美国FDA早已对这种药物进行“黑框警告”,警告使用者患甲状腺癌的潜在风险。
然而GLP-1受体激动剂已经用于治疗2型糖尿病超过15年,相关企业表示,这十几年的时间里,大型临床试验项目和上市后监测中收集的安全性数据,也都没有发现司美格鲁肽或利拉鲁肽与甲状腺癌的发生存在因果关系。
由此可见,GLP-1与甲状腺癌的纠纷已久,目前没有确实证据证明两者之间的联系。对于在研的相关企业来说算得上“无足轻重”,如何研发出效果更佳的产品才是未来的重中之重。
对于诺和诺德来说,股市波动是暂时的,2021年司美格鲁肽获批减重适应症时,黑框警告便已存在,但这并未影响其销量,2022年其收入达到109亿美元,同比增长78%,展现出“药王”资质。
与此同时,由于减肥市场需求太火,FDA已发文警告一些药店正在制造未经授权的诺和诺德糖尿病和肥胖药物,诺和诺德也对美国的五家药店提起诉讼。

诺和诺德表示,在美国对某些医疗水疗中心、减肥或健康诊所以及复合药房提起法律诉讼,以停止虚假广告、商标侵权和/或非法销售声称含有semaglutide的非FDA批准的复合产品Ozempic和Wegovy。“这些非法的营销和销售行为,包括在这些行为中使用诺和诺德商标,已经创造了高风险的消费者混淆和欺骗以及潜在的安全问题。”
不可否认的是,在近年来的全球医药市场竞争中,GLP-1是搅动市场风云的重磅靶点之一。市场观点认为,GLP-1作用机制多样化,具有长效化、多种药物形式、多靶点、多适应症等迭代和差异化的研发潜力;但是,在相关研发愈发火热之际,企业竞争、营销推广、产品安全、风险警告等情况,也进一步对合理用药造成了压力,尤其是Off-label使用应当慎之又慎。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx