近日,药物临床试验登记与信息公示平台官网显示,科伦博泰启动了一项注射用A166对比注射用恩美曲妥珠单抗(T-DM1)在既往接受过曲妥珠单抗和紫杉类治疗的人表皮生长因子受体-2(HER-2)阳性不可切除或转移性乳腺癌患者中的随机、开放、对照、多中心Ⅲ期临床试验。
HER-2阳性乳腺癌治疗领域的重磅品种层出不穷,而今抗体偶联药物(ADC)成了这条赛道上的新领跑者。在第一三共和阿斯利康联合开发和商业化的德曲妥珠单抗(DS-8201)横空出世前,罗氏开发的T-DM1曾是HER-2阳性乳腺癌晚期治疗的指南一级推荐药物,尽管英雄迟暮,但敢于与这位“昔日王者”头对头比较的药企却寥寥无几。
不过今年以来,在HER-2 ADC竞争日益激烈的产业背景下,以复星医药、科伦博泰等为代表的本土先锋药企相继发起了对T-DM1的挑战。
01 HER-2靶向治疗明显改善患者预后
乳腺癌是严重威胁女性健康的第一大恶性肿瘤,其在2020年的全球新发病例达到226万,首度超过肺癌,成为全球第一大癌种,我国每年新发的乳腺癌患者病例约有42万。根据分型,HER-2阳性乳腺癌约占所有乳腺癌的20%-30%,是各种分型中较为凶险的一种亚型。因具有进展较快、易于复发和转移等特点,HER-2阳性乳腺癌曾给患者生命带来极大的威胁,也被喻为“粉红丝带上的黑蝴蝶”。
但明确的驱动基因突变和预后指标,也让HER-2靶向治疗成为HER-2阳性乳腺癌的重要治疗手段,亦将罗氏开发的曲妥珠单抗、帕妥珠单抗这两款抗HER2单抗送进了“重磅炸弹”药物的行列。而凭借在EMILIA研究、MARIANNE研究等临床试验中展现的过硬数据,随后获批上市的HER-2 ADC T-DM1更是进一步巩固了罗氏在乳腺癌治疗领域的霸主地位。
作为国内首个上市的靶向HER2的ADC型药物,T-DM1的作用机制独特,其由靶向HER2分子的曲妥珠单抗、强效的毒素小分子DM1(美坦辛衍生物)通过硫醚连接体偶联而成,具有靶向、强效以及稳定的特点。在全球首次获批上市到现在的二十年中,从二线到一线,从辅助治疗到新辅助,从联合内分泌治疗到联合小分子药物,T-DM1在乳腺癌领域的探索实现全面开花,并展现出多维的临床应用潜力。
而此番与其对标的A166是科伦博泰研发的靶向HER-2的创新ADC,其特别之处在于通过蛋白酶可裂解连接子(linker)将新型毒素分子(Duo-5,微管蛋白抑制剂)定点偶联至抗HER-2抗体曲妥珠单抗。这种设计能够让A166靶向HER-2表达的肿瘤细胞,通过内吞作用进入细胞后,在胞内溶酶体中被切割并释放毒素分子,从而高效杀伤肿瘤细胞,兼具抗体药物的靶向性以及化疗药物的高杀伤性等特点。
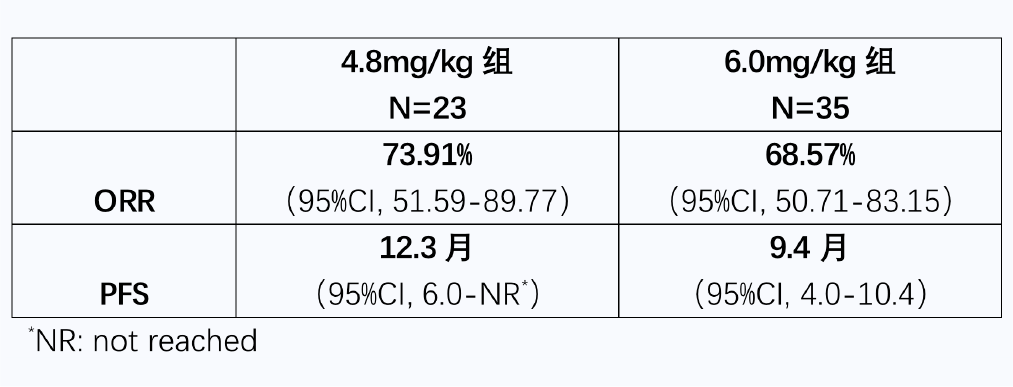
今年5月,科伦博泰对外宣布,针对A166提交的1类新药上市申请获得国家药品监督管理局(NMPA)药品审评中心(CDE)受理。适应症为既往经过二线及以上抗HER-2治疗失败的HER-2阳性不可切除的局部晚期、复发或转移性乳腺癌。在2022 ASCO年会上,由复旦大学附属肿瘤医院胡夕春教授和张剑教授团队主导的A166用于经过多线治疗的HER-2+乳腺癌患者的Ⅰ期剂量扩展研究的更新数据得到公布,4.8mg/kg组客观缓解率(ORR)为73.9%,中位PFS为12.3个月,不良反应可控,该药物的疗效和安全性再次得到验证。
此次科伦博泰启动的是一项随机、开放、对照、多中心Ⅲ期临床试验,同样由胡夕春教授担任主要研究者,拟在中国52家研究中心入组356名受试者。该研究主要目的为评估注射用A166相较于T-DM1在既往接受过曲妥珠单抗和紫杉类治疗的HER-2阳性不可切除或转移性乳腺癌患者中的有效性,主要终点指标为由BICR采用RECIST 1.1评估的无进展生存期(PFS)。次要目的为评估注射用A166相较于T-DM1在HER-2阳性不可切除或转移性乳腺癌患者中的有效性、安全性、免疫原性和药代动力学(PK)特征。
在业内看来,经过多年积累,科伦博泰成功建立了名声在外的ADC开发平台OptiDC,与默沙东达成的多笔大额BD交易足以证明业界对其创新实力的认可。而基于领先的OptiDC平台,科伦博泰的创新ADC产品已有4款进入临床研究阶段,另有多款ADC产品处于临床前研究阶段。若A166未来能够成功挑战T-DM1,毫无疑问将为科伦博泰竖起新的里程碑。
02 用T-DM1阳性对照应对临床挑战
近年来,中国医药创新如火如荼,但新药研发同质化开发现象严重。在CDE于2021年发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》下,本土药企正在积极落实以临床价值为导向,以患者为核心的研发理念,选择当前的标准治疗作为阳性对照药、科学有序地开发抗肿瘤药,是应有之义。事实上,科伦博泰的A166并非是首个与T-DM1“硬刚”的国产HER-2 ADC。
今年2月底,复星医药同样在药物临床试验登记与信息公示平台上登记了一项多中心、开放标签、随机对照III期临床研究,用来比较FS-1502和T-DM1在HER-2阳性不可手术切除的局部晚期或转移性乳腺癌患者中的疗效和安全性。FS-1502是复星医药开发的新一代靶向HER2的ADC药物,通过可切割的β-葡萄糖醛酸酯linker与抗有丝分裂药物MMAF(monomethyl auristatin F)连接。在本月刚刚落幕的2023 ASCO上,复星医药以poster的形式发布了FS-1502在RP2D剂量下的研究结果,FS-1502在2.3mg/kg每三周一次的剂量下,ORR为53.7%,mPFS为15.5个月,且耐受性良好。
而这项FS-1502与T-DM1头对头比较的临床试验则由中国医学科学院肿瘤医院徐兵河教授担任主要研究者,拟在中国60家研究中心入组314名受试者,主要的研究目的是在HER-2阳性不可手术切除的局部晚期或转移性乳腺癌患者中,比较IRC评估的FS-1502试验组和T-DM1对照组的无进展生存期(PFS)。该研究已在今年3月完成首例患者入组。
值得注意的是,靶向HER2的ADC药物当下的主角已不再是T-DM1。基于DESTINY-Breast03试验的结果,阿斯利康和第一三共联合开发的DS-8201已被新增入NCCN肿瘤临床实用指南作为1类首选方案用于二线治疗复发性不可切除(局部或区域性)或IV期HER-2阳性乳腺癌,成功取代了T-DM1的位置,这也让业界对复星医药、科伦博泰等的对照药选择不无担忧。
DS-8201是一款靶向HER2的ADC,采用第一三共专有的DXd ADC技术设计,是第一三共肿瘤产品组合中的领先ADC,也是阿斯利康ADC科学平台中最先进的项目。具体来看,DS-8201由人源化抗HER2单克隆抗体通过稳定的可裂解四肽连接子与拓扑异构酶-I抑制剂(喜树碱类衍生物DXd)连接组成。
今年2月,DS-8201获得NMPA正式批准,单药适用于治疗既往接受过一种或一种以上抗HER-2药物治疗的不可切除或转移性HER-2阳性成人乳腺癌患者。此次获批是基于DESTINY-Breast03 Ⅲ期临床试验的积极结果。这项试验结果显示,与T-DM1相比,DS-8201在既往接受过曲妥珠单抗和紫杉烷治疗的HER-2阳性不可切除和/或转移性乳腺癌患者中,将疾病进展或死亡风险降低72%。
2022年圣安东尼奥乳腺癌大会(SABCS)上公布的数据显示,DS-8201在总生存期(OS)及无进展生存期(PFS)上均表现出具有临床意义的改善,经盲法独立中心评审委员会(BICR)评估,与T-DM1相比,DS-8201中位PFS延长了22个月(中位PFS 28.8 vs 6.8个月)。截至目前,DS-8201已在超过40个国家被批准用于治疗无法切除或转移性HER2阳性乳腺癌成人患者,这些患者在转移阶段接受过至少一种抗HER2治疗方案,或者在新辅助或辅助疗法期间或之后六个月内疾病复发。
业界普遍认为,随着适应症范围的不断拓宽,DS-8201俨然已成为HER-2阳性乳腺癌治疗领域的新霸主,进阶国内乳腺癌临床指南一级推荐仅是时间问题,留给本土药企进行临床开发的窗口期并不会太长。但就目前的临床实践现状而言,国产HER-2 ADC玩家综合利弊选择T-DM1作为阳性对照,或是当前应对临床开发挑战的最好选择。