2023年4月27日,CDE官网最新显示,上药中西制药递交的溴吡斯的明缓释片临床申请获CDE临床默示许可,用于治疗重症肌无力。

来源:CDE官网
溴吡斯的明是Valeant开发的一款胆碱酯酶抑制剂,通过增强神经肌肉的信号传递作用,达到改善患者肌无力症状的目的。溴吡斯的明被广大患者称为“小明”,是治疗各类型重症肌无力的一线药物,并可作为单药长期治疗眼肌型等重症肌无力患者。
溴吡斯的明片最早于1955年4月6日获FDA批准首次在美上市,商品名是Mestinon®;1995年,上药信谊首仿的溴吡斯的明片经NMPA批准在国内上市。
药渡数据显示,目前全球已上市的溴吡斯的明有4种剂型:溴吡斯的明糖浆、溴吡斯的明缓释片、溴吡斯的明注射液和溴吡斯的明片。
根据药渡数据调研,目前溴吡斯的明所有原研剂型均未进入国内。
国内经NMPA批准上市的只有溴吡斯的明片这一种剂型,且为国内企业仿制药品,涉及企业有:海南凯健制药、上药信谊和上药中西,后两者都属于上海医药集团。目前尚未有企业进行该品种的一致性评价申报。
Horizon/广州汉光联合申报的溴吡斯的明口服溶液5.2类上市申请于2023年2月16日获CDE正式受理。这是溴吡斯的明口服溶液作为全新的一款剂型首次在国内进行进口药品注册申报。
2020年9月北京罕友向CDE递交溴吡斯的明缓释片新5.2类进口申报,2021年10月27日更新状态为“未批准”。
北京罕友虽首战不利,却越挫越勇,又于2022年7月11日再次递交溴吡斯的明缓释片的临床申请,目前CDE已受理。上药中西制药于今年2月8日向CDE递交的溴吡斯的明缓释片临床试验申请于今日获CDE临床默示许可,正式吹响国内企业进军“小明”的冲锋号。

来源:药渡数据-中国注册库
药渡数据-中国销量库统计,国内市场溴吡斯的明片销售呈逐渐增长态势,2021年度全国医院销售总额5748万元,且被上药信谊和上药中西垄断,其中上药中西占据溴吡斯的明片全部市场份额的9成以上。
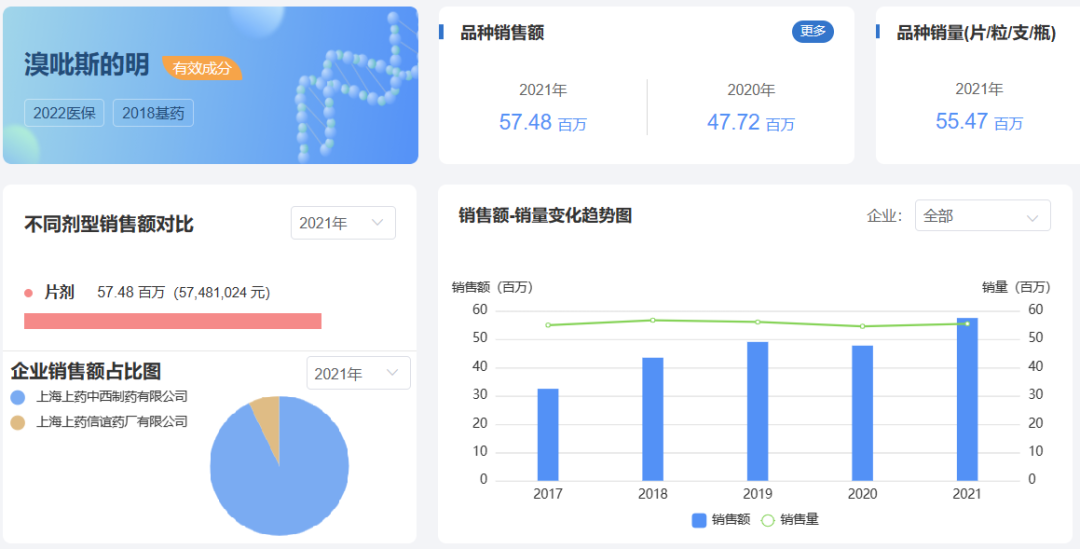
来源:药渡数据库-中国销量库
重症肌无力(MG)是一种罕见的、慢性自身免疫性疾病,由针对突触后膜上乙酰胆碱受体、肌肉特异性激酶或其他乙酰胆碱受体相关蛋白的自身抗体引起,会导致神经肌肉接头传递受损,可不同程度影响眼球运动、吞咽、言语、活动和呼吸功能,约85%的患者会出现眼肌以外的症状,发展为全身型重症肌无力(gMG),甚至发生肌无力危象,已被纳入我国《第一批罕见病目录》。
目前,重症肌无力的主要治疗方法包括胆碱酯酶抑制剂、糖皮质激素以及免疫抑制剂,但仍有部分患者因药物疗效、耐受性或使用禁忌等问题无法充分有效地控制病情,存在大量未被满足的临床需求。
相较于其他对症药物来说,溴吡斯的明安全性更高,不良反应发生率更低,大部分患者均可耐受;且因其价格的巨大优势,治疗成本压力不大,可及性高。根据北京爱力重症肌无力罕见病关爱中心的一项调研数据显示,86%的重症肌无力患者都使用或使用过溴吡斯的明,这是在重症肌无力患者中使用最多的一种药物,并且被《中国重症肌无力诊断和治疗指南(2015年版)》推荐为所有类型重症肌无力的一线药物,可作为单药长期治疗轻型重症肌无力患者。期待上药中西制药的临床试验顺利进行,为国内高质量药物上市打好基础,早日为国内患者带来更优质的治疗选择。
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx