以下文章来源于注册圈 ,作者悬舞微光
与10万医药人助力中国医药腾飞
为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),这些年来NMPA连同CDE在简化药品审批程序方面出台了众多政策和措施,其中针对原辅包的主要政策就是推行了原辅包关联审评审批措施,主要包括出台一系列政策文件、建立原辅包登记平台、施行原辅包登记管理、不强求原料药单独审评审评,取消药用辅料和药包材行政审批等。本人基于自身的法规学习和实践经验,推出“原辅包关联审评系列文章”,计划从政策变迁及提炼、核心政策对比与分析、登记资料要求解析、关联审评审批制度解析、经验分享与注意事项等方面给大家系统展现原辅包关联审评审批相关政策理论与实践经验,为大家系统掌握相关知识提供参考。此外,由于本人经验有限,其中不足及有误之处,还请大家多多包涵,多多指正,咱们相互学习,共同提高,在此致以衷心的感谢!
本文是“原辅包关联审评系列文章”的第一篇,通过对2016年到2022年11月期间相关法规的系统梳理,展现法规政策的变迁轨迹,去除相关性不大和过期失效的法规,提炼出与主线密切相关的现行版核心法规政策,让大家从历史和全局的视角了解原辅包关联审评审批,同时提炼出目前最需要关注的核心法规,以便大家能重点学习。
▲ 表1:原辅包关联审评政策列表(2016~2022.11)
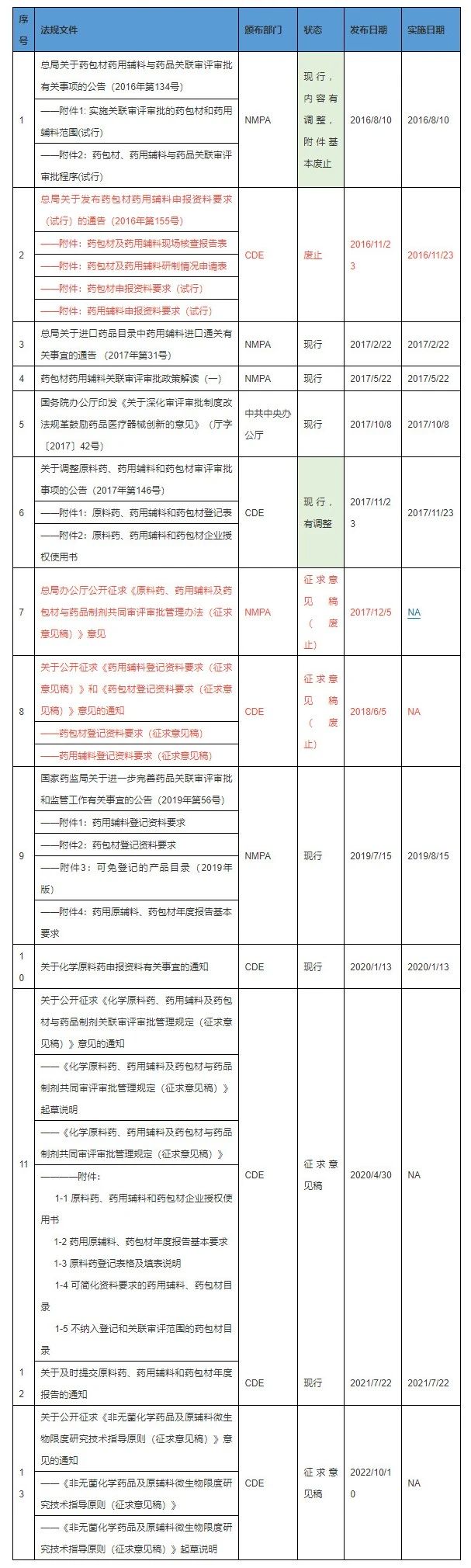
▲ (表格可点击放大查看)
由政策列表可知,药用辅料和药包材的关联审评审批始于2016年。NMPA发布了第134号文,首次提出药用辅料和药包材进行关联审评审批,并对其基本要求、范围、程序进行了规定。CDE发布了第155号文,对申报资料要求、研制现场核查申请及核查等进行了规定。在2017年5月,NMPA发布《药包材药用辅料关联审评审批政策解读(一)》对这两个政策进行解读。此时需注意:
1)关联审评审批的范围还只是药用辅料和药包材,对于化学原料药的关联审评审批尚未明确。
2)此时药用辅料和药包材的行政许可尚未取消,因此还保留审批程序。
3)政策解读题目中虽然有个“一”,但调研未发现后续有“二、三……”等政策解读发布,因此这版政策解读,也是目前能找到的唯一的解读文件。
大约半年后,在2017年10月8日,中共中央办公厅、国务院办公厅发布《国务院办公厅印发《关于深化审评审批制度改法规革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)》,其中第十二条规定:与药品注册申请一并审评审批的除了药用辅料和药包材之外,还有原料药。
为贯彻落实中共中央办公厅、国务院办公厅的上述意见以及另一个决定(《国务院关于取消一批行政许可事项的决定》(国发〔2017〕46号)),CDE在2017年11月23日,发布了《关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)》,其核心点包括:
1)取消药用辅料与药包材的审批,也就是说药用辅料和药包材只有审评,无需审批,但原料药还是需要审批的。
2)对于原料药的关联审评审批做了相关规定,以充实对“厅字〔2017〕42号”文中的相关规定。
3)明确了原辅包关联审评前需要先在CDE登记平台上进行登记,并对原辅包登记做了相关规定,明确了原辅包登记范围、登记资料要求、登记平台过渡时期的相关要求,以及对各相关方的职责要求。
4)提出年报的要求。
在接下来一年半多的时间里,关于原辅包关联审评的政策较少,只有两个征求意见稿,并没有正式的政策,直到2019年7月,NMPA再次发文,即《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年第56号)》,对原辅包关联审评审批及监管做了进一步完善的规定,截止目前56号文是原辅包关联审评现行的最新正式法规文件,也是最需要关注的核心政策之一,对于2016年134号文和155号文、2017年146号文进行了修订、取消及完善!其核心内容及意义如下:
1)登记范围明确为境内研制、生产、进口和使用的原料药、药用辅料、药包材,取代134号文及其附件1、146号文的相关规定。
2)公布了药用辅料和药包材登记资料的最新要求,155号文作废,征求意见稿作废。
3)公布了2019版可免登记产品 目录,为目前现行版的可免登记产品目录。
4)明确对于因特殊原因无法登记的原辅包,可在药品制剂申报时一并提交研究资料,不用必须登记。
5)完善原辅包登记人、制剂注册申请人或药品上市许可持有人、监管部门的要求,但通过对比发现134号文和146号文中相关规定依然可用。
6)明确了登记标识“A”和“I”的意义,以及自动转“A”的要求。
7)关于收费,明确了药用辅料和药包材已取消行政审批不再收费,而原料药依然需要行政审批和收费。
8)对于“原辅包登记信息的使用和管理”和“监督管理”进行了较为详细的规定。
从政策类型看,从2016年至今,关于原辅包关联审评的正式要求都是以公告、通告、通知的形式进行发布,始终不见一个系统的管理规定或指导原则出台,这就导致一系列的要求会分散在多个文件中,不过这也说明相关制度出台存在较多不确定性和困难。从调研情况看,这个管理制度目前已经公开征求意见了两次:
2017年12月,NMPA发布《总局办公厅公开征求《原料药、药用辅料及药包材与药品制剂共同审评审批管理办法(征求意见稿)》意见》首次征求意见。
2020年4月,CDE发布《关于公开征求《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》意见的通知》再次征求意见。
但时至今日,两年半的时间又过去了,依然没有出正式稿,所以相关政策只能参考2020年4月最新的征求意见稿,因此其也是需要关注的法规文件之一。另外,由于该征求意见稿的发布,2016年134号文的附件2《药包材、药用辅料与药品关联审评审批程序(试行)》可无需关注。
此外,关于年报,CDE已于2021年7月22日发布通知,由于疫情的影响,取消递交年报的时间限制。目前该通知仍在生效中,因此年报递交可基于原辅包生产企业的情况适时提交即可。
基于政策法规的梳理,提炼出需要重点关注的法规,按重要程度排序如下:
1)2019年第56号文及其四个附件:《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年第56号)》
2)2020年版《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》
3)2017年146号文及其两个附件:《关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)》
4)2016年134号文正文:《总局关于药包材药用辅料与药品关联审评审批有关事项的公告(2016年第134号)》【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx